本記事では、「細胞の3次元培養の特徴とその培養方法」についてまとめていきます。
再生医療・組織工学では細胞を立体的に培養する3次元培養が注目されています。
この記事では3次元培養について、
- 2次元培養の課題について
- 3次元培養とはなにか
- 3次元培養はどんな方法があるか
の項目についておさらいします。
3次元培養という技術は再生医療の発展とともに耳にする機会が増えてきているように感じます。
そんな3次元培養ですが、意外と歴史も古くどんどん新しいものが出てきており、創薬開発の分野でも注目を集めてきているホットな培養方法になってきています。
3次元培養と一言で言っても、多種多様な培養技術が開発されてきていて、
「どんな方法があるのか?」
「どんな特徴があるのか?」
を整理したく、この記事でおさらいしながらまとめていきたいと思います。
本当はそれぞれ深掘りしたいのですが、種類が多いので、まずはこの記事で基本的な3次元培養方法の概要についてまとめます。
その各項目の深掘りや、もう少し応用的な新しい培養技術については別の記事でまとめて、集約していきます。
「再生医療のアトリエ」は私が大好きな研究である、再生医療・組織工学という人工的に臓器を作る研究について「とにかく楽しく、わかりやすく」をモットーに叡智を綴る場所です。
よかったところ、わかりにくいところ、もっと知りたいところなどコメントいただけると嬉しいです。
2次元(2D)培養とはなにか、その課題について

従来の培養方法
2次元培養は、細胞を培養皿上などの平面に接着させて培養する方法のことを指します。
その原理は過去記事の「細胞接着について」で解説をしていますが、平坦な基板の上に、細胞接着性のタンパク質が吸着し、その上に細胞が接着している培養状態です。
3次元培養という細胞を3次元の環境で培養する新しい手法に対して、従来の培養方法と言われていることもあります。
“従来の”とは言っても、これまでもこれからもまだまだ広く用いられるスタンダードな培養方法だと思います。
実際、簡単なことからも、基礎的な細胞生物学的な研究から創薬開発の薬効評価など、様々な用途で使われています。
生体と異なる環境と機能
2D培養から3D培養への移行が注目されている理由として、2D培養は生体の臓器中の細胞とは異なる環境にあり、本来の機能が発現できていないことが挙げられます。
細胞培養の技術が1907年から開発されてきて、培地の開発なども進んできました。
これまでは細胞の培養、細胞の機能を評価する実験、細胞のメカニズムを解明する実験の多くは2次元培養を行ってきました。
既に実験方法も評価方法も成熟していると言っても過言ではないような2D培養ですが、
「2D培養では体の中の状態や現象を正確に再現できていない」という問題を抱えています。
実際の体の中の細胞は
- 細胞-細胞間相互作用
- 細胞周囲の硬さ
- 細胞-ECM相互作用
- 上記の立体的なつながり
- 各臓器ごとの異なる栄養素・成長因子の作用
といった環境に置かれています。
これをプラスチックの表面上だけで再現することはできません。
細胞の活性や分泌、薬の応答性などの各種機能について、2Dは生体の機能を十分に再現できていないことが研究でも明らかになってきています。(PubMed)
そこで、より体の中に近い機能を発現した細胞を得るために、足場材料や細胞の加工を駆使して、体の中の環境に近い3D培養への取り組みが進められています。
3次元(3D)培養とはなにか

細胞を立体的に培養
3D培養は細胞を縦×横×高さ方向(3D)に積み上げ状態や、立体的な環境の中で培養する方法です。
積み上げる材料は
- 細胞
- 足場材料(タンパク質、合成高分子など)
- 成長因子
という、組織工学でも言われている3つの要素になります。
2D培養では基本的には
- 隣り合う細胞同士の接着
- 底面でのECMとの接着
によって細胞やECMとの相互作用が起きていました。
3D培養では細胞や足場材料を立体的に積み上げて培養することで、2D培養ではできなかった細胞やその他因子との立体的かつ豊富な相互作用、環境などを再現できると考えられています。
実際に、3D培養では2D培養と比べて
- 細胞の機能が向上
- より生体に近い薬剤応答
を示していることから、3D培養を行う価値は十分にあると考えられています。
3次元培養の歴史は思っているよりも古く、
1972年にマイクロキャリア担体上に細胞を接着させて培養する方法や、中空糸担体内での培養が始まりと言われているようです。
1980年頃には皮膚の三次元組織の作製も成功しているようで、再生医療の始まりもここら辺がスタートと言われています。
1986年頃から細胞外マトリックス(ECM)を使った3D培養の方法も開発され、現在もオルガノイドの培養で欠かせないマトリゲル(マウス腫瘍組織抽出物)はこのときから使われています。
その後、生体由来のタンパク質材料や、合成高分子などのバイオマテリアルを使った3次元培養が進められ、1993年にLangarとVacantiが「組織工学(Tissue engineering)」という分野の提唱を行いました。
こういった歴史の流れで、iPS細胞の開発などの後押しもあり、3D培養が注目されているように感じます。
3次元培養の方法の概要と特徴について
それでは3D培養の個人的に代表的な方法についてまとめていきます。
3D培養には、
- 足場あり(Scaffold)
- 足場なし(Scaffold-free)
という考え方があります。
とは言いながらも、培養方法が複雑化してきて境界が曖昧になってきているのが現状です。(Scaffold-freeでもScaffoldを使うともっと良くなるのでは?ということで、タンパク質成分を混ぜてみたり…など)
同じジャンルの中でも足場があるものと無いものが出てきているので、そこの区別はこの記事では特にしないでまとめます。
主な3D培養は下記の通りです。
- スフェロイド
- オルガノイド
- ゲル
- スポンジ
- ファイバー
- エレクトロスピニング
- ビーズ(カプセル)
- 脱細胞
- Organ-on-a-chip
- 3Dプリンター
- 細胞シート
スフェロイド

概要
細胞がお互いを足場にして接着しあって、細胞の凝集体を形成させる培養方法です。
細胞を米粒として見たときに、おはぎのようなイメージですね。
簡便に3次元培養ができ、臓器に近い機能や薬の応答を発現させる目的で使われます。
球体(Sphere)のようなもの(oid)でSpheroid(スフェロイド)と呼ばれています。
培養方法
細胞を非接着性の基板上で培養すると、細胞が基板に接着することができなくなります。
細胞は接着しないと生存することができないため、細胞同士がお互いを足場として接着することで塊を形成することを利用して作製します。
主な作製技術は下記のものがあります。
- 細胞非接着性表面のウェルプレート
- ハンギングドロップ
- マイクロウェルプレート
- 磁気浮上
- 撹拌、振とう式培養リアクター
- マイクロパターニング
- 遠心力
- マイクロ流路でビーズ など
特徴
スフェロイドの特徴は、2D培養よりも細胞-細胞間の結合が多く生体に近い機能、薬剤応答を示すことです。
簡単な方法で、一度に作ることができる個数が多いこともメリットですね。
一方で、あまり大きいサイズのスフェロイド(200 μm以上)になると、スフェロイドの中心部分への酸素や栄養の供給が不十分になり内部壊死を起こす問題があります。
3次元の形態を取っているものの、臓器の本来持つような構造の形成は不十分で完全に生体の機能や応答を再現できていない課題もあります。
培養例
- 脳
- 心臓
- 肝臓
- 膵臓
- がん など
オルガノイド

概要
臓器(organ)のようなもの(oid)ということでOrganoid(オルガノイド)と呼ばれています。
スフェロイドに似た細胞の凝集体のような形態をしているものから、人工的な培養基板を含んだものまで多種多様な構造を持っていることが特徴です。
スフェロイドよりも更に臓器に近い機能を発現させるために用いられています。
形態がスフェロイドと似ているものが多いことから、オルガノイドとスフェロイドの違いについて悩ましいところがあります。
オルガノイドの定義としては下記の特徴を有していることが言われています。
- 複数種類の細胞から構築されていること。
- 臓器の特徴的な構造を持っていること。
- 多能性幹細胞や臓器前駆細胞から生成されること。
特にスフェロイドと似ているような細胞の塊の形態において、スフェロイドとオルガノイドの主な違いは、「細胞凝集体の内部に生体に近い構造を有していること」や「臓器の細胞不均一性を再現していること」が挙げられます。
培養方法
形態がたくさんあるため、様々な作り方がありますが、代表的なものは下記の作り方があります。
- 基底膜成分を豊富に含むゲル(マトリゲル)
- 細胞接着領域を制御した基板
- 撹拌、振とう式培養リアクター
- バイオプリンティング
- マイクロ流路
- マイクロチャンバー
特徴
スフェロイドよりも実際の臓器に近い構造や機能が発現しているため、体の外で体の内部のような機能を再現するためにはスフェロイドよりも有利とされています。
この理由から、創薬の分野ではオルガノイドの方が生体に近い薬剤応答や毒性応答を示すためオルガノイドの注目が高まっています。
幹細胞や前駆細胞から作ることが多いため、オルガノイドの形成に時間とコストがかかるところがデメリットと言われています。
スフェロイドではバラバラな細胞を固めるだけである程度の機能がすぐに発現するのに対して、オルガノイドは形が形成されるまでの培養期間が長い(数十日単位)ことから、どちらが優れているという議論よりも、評価する目的に応じて使い分けるのいいのでは…という意見が多いように感じます。
培養例
- 脳オルガノイド
- 肺オルガノイド
- 心臓オルガノイド
- 肝臓オルガノイド
- 腸オルガノイド
- がんオルガノイド
ゲル

概要
細胞とハイドロゲル(足場材料)を使った培養方法です。
臓器の中の細胞は、豊富なECMに囲まれて存在しています。
そのような環境をゲルで再現することで、細胞が臓器に近い機能を持つのでは?ということで開発された培養方法です。
使うゲル材料は天然材料(コラーゲン、フィブリン、マトリゲルなどのタンパク質やアルギン酸、キトサンなどの多糖類)と人工材料(ポリエチレングリコール(PEG)、ポリビニルアルコール(PVA))があります。
培養方法
ざっくり分けると、細胞を
- ゲルに混ぜて培養する方法
- ゲルに挟んで培養する方法(サンドイッチ培養)
があります。
混ぜて培養する方法では、バラバラに単離した細胞をゲル前駆体(ゲルが固まる前のもの)に混ぜ、ゲル化、培養をします。
培養皿状に液滴をのせてゲル化する培養方法もあれば、鋳型に流し込んで形を持ったゲルで培養する方法、マイクロ流路を使って紐状やビーズ状にして培養する方法があります。
ゲルに挟んで培養する方法では、一度固めたゲルの上に細胞を培養し、その上から更にゲルをのせて培養する方法です。
ゲルで細胞を挟んでいることからサンドイッチ培養と呼ばれています。
細胞とECMの結合の極性制御(細胞同士の結合する部分、細胞とECMが結合する部分の方向性の制御)ができることが魅力的なところとされています。
特徴
臓器中の細胞と同じ環境である
- 細胞-ECM相互作用
- 細胞の外の硬さ環境
を再現することができると期待されています。
ゲルを用いた培養では、細胞接着、分化、形態、増殖、遺伝子発現の多くの細胞の機能を制御することができると言われています。
オルガノイド培養もマトリゲルに包埋して培養したものはこちらに分類されます。
この場合、マトリゲルが含む基底膜成分のECMや成長因子などが細胞接着、分化、形態、硬さなどを制御することでオルガノイドの形成を進めていると考えられています。
組織工学の三大要素の一つである足場の代表的な材料として、とても重要な培養方法です。
培養例
- 心臓
- 血管
- 肝臓
- 皮膚
- がん など
スポンジ
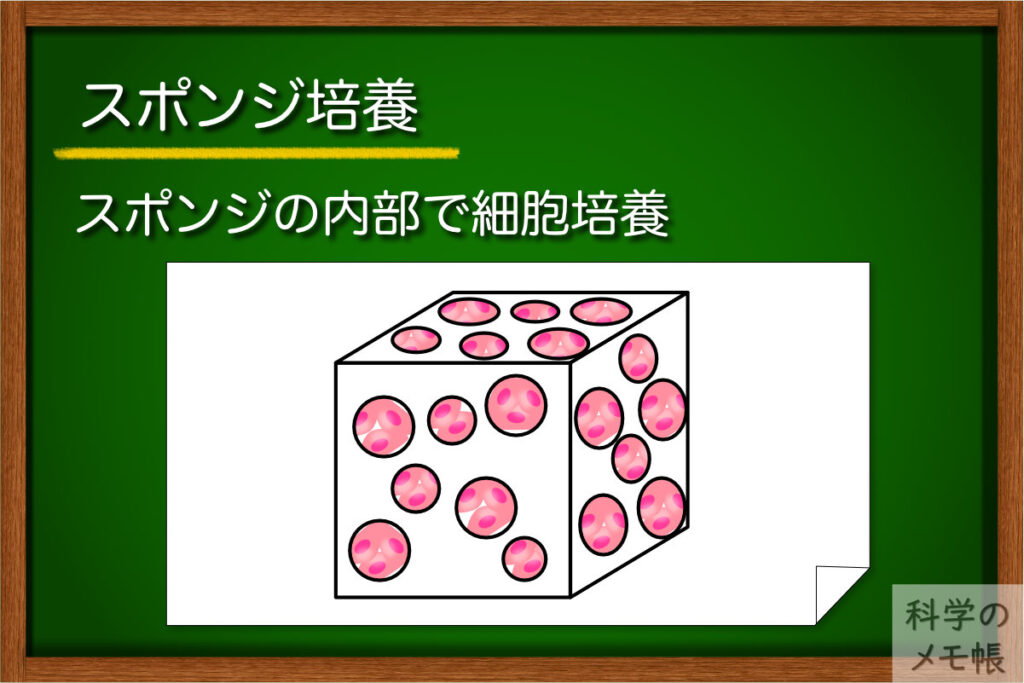
概要
スポンジの中に細胞を染み込ませて3次元的に培養する方法です。
スポンジは、コラーゲンなどのタンパク質や人工高分子材料の溶液やゲルを凍結乾燥させるなどして多孔質な状態にすることで作製します。
ここに細胞を播種することで、スポンジの隙間の中に細胞が入り、立体的な足場の中で細胞-ECMの接着や細胞-細胞の接着が3次元的に起こります。
多孔質な構造を利用して細胞と足場の相互作用、培養液の供給によって細胞に臓器に近い機能を発現させることを目的に用いられています。
培養方法
基本的な材料としてはゲルでも取り上げた天然材料(コラーゲンなど)や人工材料(ポリ乳酸など)が使われます。
細胞播種は、スポンジが水を吸いやすい構造をしていることを利用します。
スポンジに細胞を懸濁した培養液を滴下するだけで、スポンジが細胞懸濁液を吸い取り、簡単にスポンジの内部まで細胞を入れて培養することができます。
特徴
上記の様に、スポンジに細胞懸濁液を染み込ませるだけで簡単に3D培養ができる点が魅力的な部分です。
凍結乾燥によって作製するときに、凍結方法を工夫すると、氷の結晶の形を制御することができ、スポンジ内の穴の方向を一方向にすることもできます。
ここに細胞を入れると細胞は穴の方向に沿って伸展するため、配向性(細胞が伸びる方向)を制御することができます。
筋肉のような筋線維が一方向に揃った組織を作ることができそうですね。
課題は、機械強度が低いことで、細胞を播種、培養していると細胞の張力による変形や収縮が起こることが挙げられます。
これが起こると、本来取りたい形が取れなくなる、細胞密度が上がり内部壊死が起こるなどの問題が生じるとされています。
培養例
- 骨格筋
- 軟骨
- 肝臓 など
ファイバー
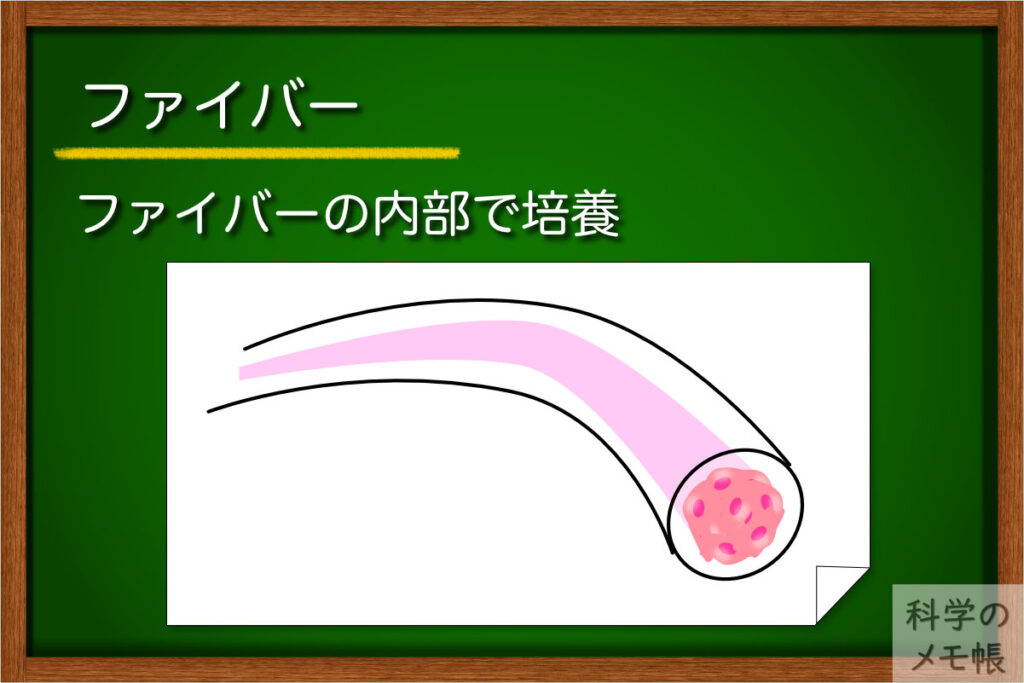
概要
細胞を紐状に加工する培養方法です。
主にゲルと組み合わせて細胞の紐を作ります。
ゲル培養の応用系の一つですね。
“ひも”という形状を利用して均一な3D培養や、血管のようなチューブ構造を形成するなどの目的で用いられています。
繊維構造が特徴的な筋肉の細胞とも相性が良いと考えられており、培養肉への応用も期待されています。
培養方法
マイクロ流路などをつかって、内側を細胞、外側をゲルのシェルで覆ったような形状を形成する作製方法が代表的です。
この他にも後述するプリンターを使って、細胞とゲルを直線上に印刷して作る方法もあります。
しっかり制御して品質の良いファイバーを作るためには特殊な装置が必要になるものの、非常に簡単に、同じ品質のものを大量に作ることができるところが作り方の特徴でしょうか。
特徴
ファイバーという「どの部分でも太さが均一」という特徴を活かし、芯となる細胞部分は培地から供給される栄養素や酸素を均一に受け取ることができるところが魅力の一つです。
ただ細胞の凝集塊を作るだけでは、スケールアップするときに細胞の塊が大きくなり、内部壊死が起こることが課題とされています。
このファイバーの培養方法ではスケールアップする際は長さで制御するため、内部壊死を抑制することができると言われています。
作ったファイバーは培養の用途でも使われますが、更に大きな組織を形成したり、移植することにも用いられる可能性が示されています。
培養例
- 筋肉
- 神経
- 肝臓
- 膵臓
- iPS細胞 など
エレクトロスピニング
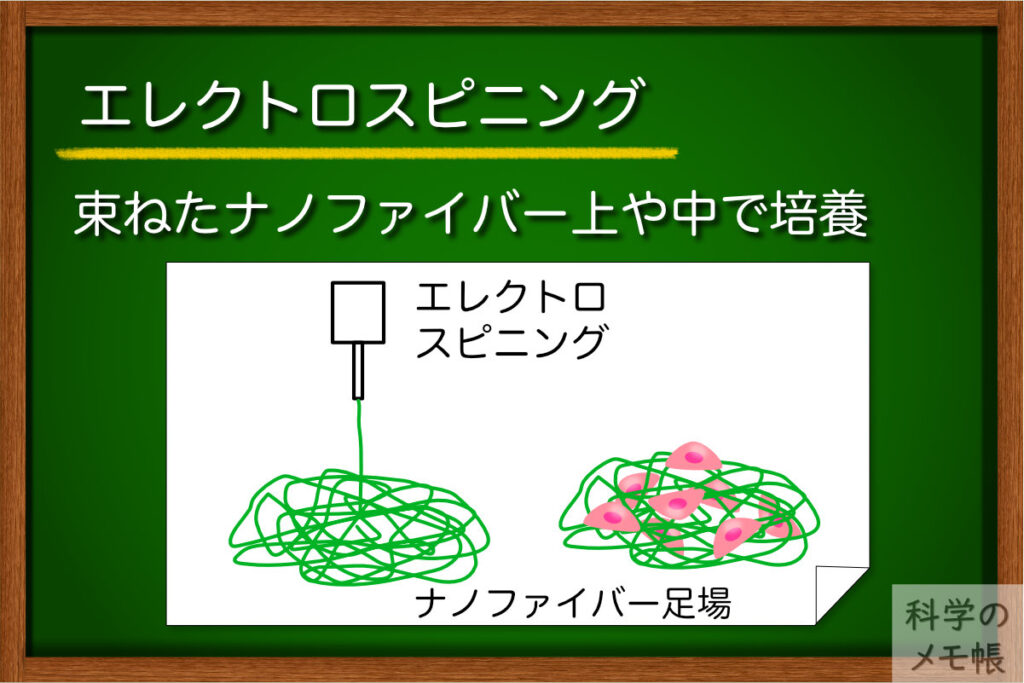
概要
エレクトロスピニング(電界紡糸法)という、ナノファイバーを作る技術を使って細胞の足場を作り、その上で細胞を培養する方法です。
臓器の中のECMはナノメートルサイズのタンパク質の繊維という特徴を持っています。これを人工的に再現した培養環境を作ろうというのがこの培養方法の目的です。
ゼラチン、コラーゲンなどのタンパク質やポリ乳酸などの材料を用いることが多いですね。
培養方法
エレクトロスピニングで作製した繊維(直径nm〜μm)を束ねたり、不織布のようにシート化したりすることで足場材料を作ります。
その上に細胞を播種、培養を培養します。
束ねる繊維の密度を変えることで、繊維で作られたシートの上で培養する方法や、繊維で作られたスポンジのような構造の中で培養する方法があります。
特徴
繊維上に接着した細胞は繊維に沿って伸展する性質があります。
繊維方向を1方向に束ねた足場で細胞を培養すると、細胞の伸展方向を制御することができるところが応用的な培養方法として注目されています。
筋肉や神経といった、細胞の伸展する方向が一定になっている(配向)組織を再現することができますね。
培養例
- 骨格筋
- 神経
- 心筋 など
ビーズ(カプセル)

概要
細胞をカプセルの中に閉じ込めて、内部で凝集体を形成するような培養方法です。
細胞凝集体の大きさの制御や外部からの刺激の保護を目的として用いられます。
培養方法
形状がシンプルなだけあって、様々な作り方が開発されています。
- マイクロ流路を用いて細胞懸濁液をゲル成分で包み、閉じ込める
- インクジェット、ディスペンサーによって細胞懸濁液の液滴を形成、ゲル化
- 遠心力による液滴形成
- 電界による液滴形成
特徴
スフェロイドと異なり、細胞凝集体の表面をゲルのシェルで覆うことができるところが大きな特徴です。
内側(コア)と外側(シェル)の2層構造を作ることで多種類の細胞から構成されるビーズを作ることも可能になります。
また、ゲルのシェルを溶かすなどして除去して細胞のみを回収することも可能です。
シェルを残したままにすることで、内部の細胞を外部から保護することで、移植の免疫反応の回避としても使える可能性があるとされています。
ゲルを使うことでスフェロイドでは不足している、細胞-ECM相互作用を付与することができるというところも特徴ですね。
多量に作製することができるため、ハイスループットの解析への応用が期待されています。
培養例
- がん
- 膵臓
- 間葉系幹細胞
- iPS/ES細胞 など
脱細胞
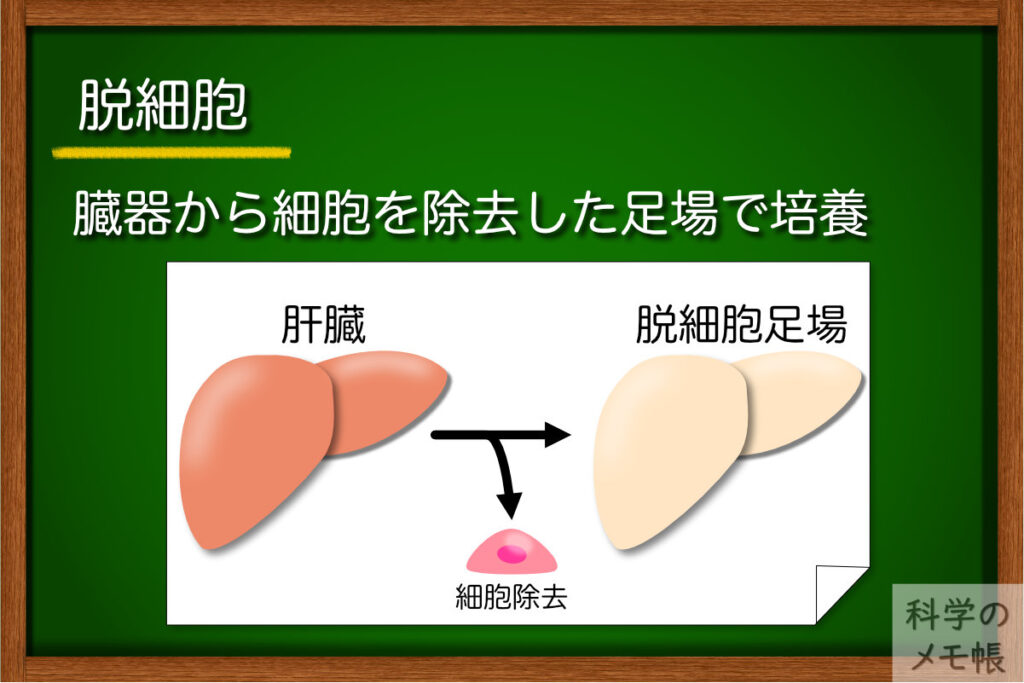
概要
わざわざスポンジを作ったりゲルの成分を考えたりと、人工的に培養環境を用意しなくても臓器のタンパク質をそのまま使ったら良いのではないか?
ということで開発されたのが、臓器から細胞を除去して残ったECMの成分や骨格を足場にして細胞を培養する技術です。
培養方法
臓器の中に脱細胞化剤(界面活性剤、酸、塩基など)を流し込んだり、凍結溶解させたり、物理的に圧力をかけたりして臓器から細胞を除去することでECMの足場を作ります。
上記のスポンジ培養みたいに、残ったECMの構造物に細胞を再播種することで培養します。
ECMをそのまま使うだけでなく、ECMを溶かして、ゲルの材料にして使う方法もあります。
特徴
元々の臓器を構成しているタンパク質を使って細胞培養ができるところが魅力な点です。
臓器ごとにECMの組成がことなり、細胞は本来の臓器のECMで培養したほうが機能発現が臓器に近いものになるということがわかってきています。
この点からも組織工学や再生医療ではかなり注目度が高い培養方法の一つだと思います。
タンパク質を変性させずに細胞だけを除去する方法が難しいことや、処理に時間がかかる(長いもので1ヶ月以上)ところが課題とされています。
培養例
- 心臓
- 肝臓
- 肺
- 気管
- 血管 など
Organ-on-a-chip
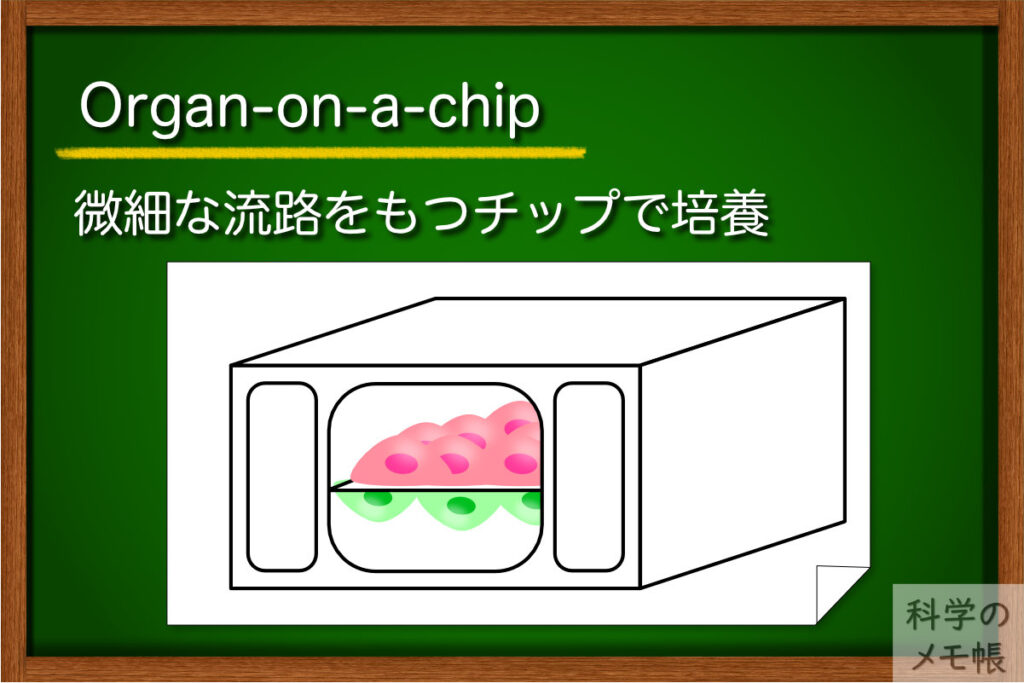
概要
シリコーン樹脂、プラスチックなどの基板に微細加工技術を用いてμmレベルの細い流路を持つチップを作製します。
その流路構造を持つチップ内で細胞を培養、培養液を灌流して培養することによって臓器の機能を持った小さなチップを作ります。
デザインする基板形状でその形は多種多様です。
創薬開発の分野では動物実験代替の流れがある中で大きく注目されている3次元培養法の一つです。
培養方法
用意した微細な流路構造を持つ基板に細胞を播種して培養します。
例えば、肺organ on a chipの場合、2つの流路を数μmの穴が空いたメンブレンで仕切り、片面に肺上皮細胞、裏面に血管内皮細胞を接着させることで、肺から血管への物質交換や細菌感染について評価するチップを作ることができます。
肺organ-on-a-chipのように肺上皮細胞を腸の細胞や肝臓の細胞などに変えて様々な臓器にも応用されています。
特徴
小さなチップ上で臓器に似た構造、機能を再現することができる培養方法として、創薬研究などで大きく注目されています。
オルガノイドなどの組織に比べて、狙った臓器の構造(細胞と血管の物質交換など)を作ることができるため、目的の評価を行いやすいことが良い点といえます。
一つのチップの上に複数の細胞を培養したり、1種類の細胞から作られたチップをつなぎ合わせたりすることで、複数の臓器の繋がりを再現、評価することができるので、応用の幅がかなり広いです。
薬の吸収、分布、代謝、排泄などの薬物動態を評価するツールとしても期待されています。
主な課題は、複数種類の細胞を培養するための最適化された培地がまだないということ。
人間の体の血液とか組織液とかの凄さを実感しますね。
また、organ-on-a-chipの形状に合わせた機能を評価するための適切な評価装置、機構がまだなく、開発の余地があるとされています。
培養例
- 肝臓
- 肺
- 心臓
- 腸
- 血液脳関門
3Dプリンター
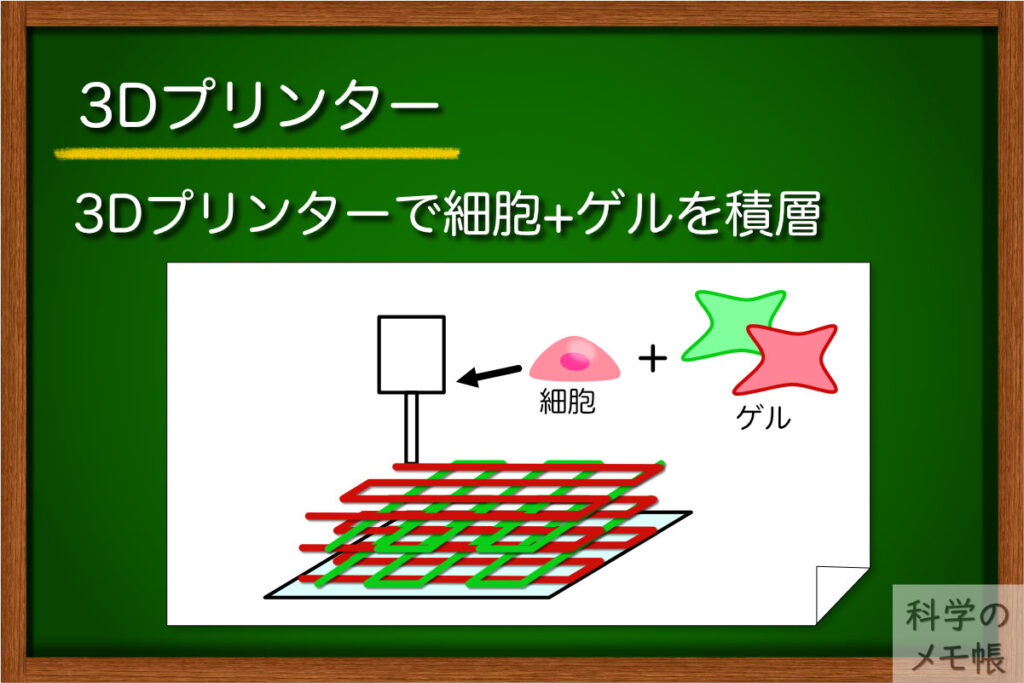
概要
プリンターを用いてインク(細胞やゲル)を立体的に配置することで臓器のような構造を作る培養方法です。
臓器は複数種類の細胞が立体空間に分布して構造が形成されています。
立体的に材料を配置し、形を作り、多色印刷もできる3Dプリンターであれば、細胞を適切に配置、立体的に形を作り、臓器を再現できるのでは?ということで注目されている技術です。
培養方法
インクとなる細胞、ゲル、成長因子などを用意します。
3Dプリンターでインク材料の細胞やゲルを1層ずつ配置、積層することで立体的な形状を作っていきます。
3Dプリンターの方式は
- インクジェット
- ディスペンサー(押出)
- レーザー
- ステレオリソグラフィ
など、様々な方式がありますが、基本的には1層1層積み重ねて行くことで形を作ります。
特徴
細胞を培養液に懸濁したものをインクとして印刷しても、液体は流れてしまい、立体造形ができません。
基本的には細胞+ゲル材料を混ぜたものを印刷し、瞬時にゲル化させることで、細胞を目的の場所に留めて3次元的に印刷を行います。
細胞が培養できて、3Dプリンターで印刷できるようなインクとなる材料(ゲルなどのバイオマテリアル)の開発が重要なポイントになりますね。
ゲルを使わずにスフェロイドのみを積み重ねることで立体造形を行う、特殊な3Dプリンターもあります。
培養例
- 心臓
- 皮膚
- 血管
- 肝臓
- 腎臓
- 骨、軟骨
細胞シート
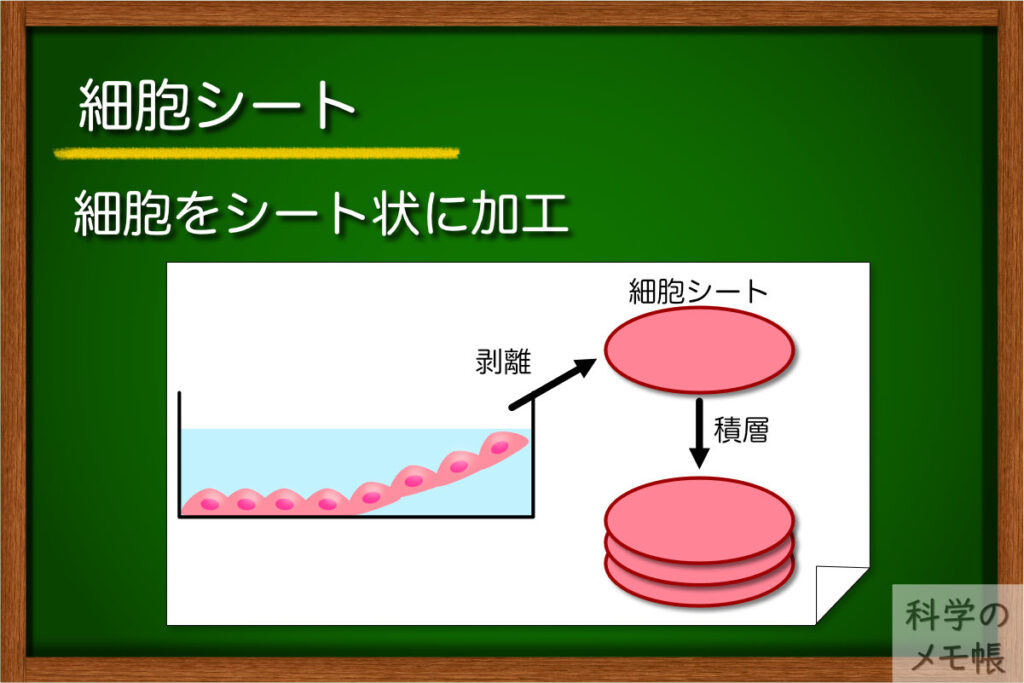
概要
細胞を使ってシートを作製し、重ねることで細胞を立体的にします。
2Dで培養した細胞は細胞-細胞の結合や、細胞-ECMの結合を形成しています。
温度によって培養した細胞を剥がすことができる特殊な培養皿を使うことで、2D培養で形成した結合を維持したままシート状の組織を作ることができるのが特徴です。
培養方法
温度応答性培養皿(37℃で細胞接着、20℃で細胞非接着性になる)の上に細胞を高密度で播種、培養します。
細胞同士が結合したら、培養皿を冷やして20℃にすると、培養皿上の細胞がシート状に剥離することができます。
剥がしたシートを重ねて培養することで3次元の細胞組織を作製することができます。
特徴
酵素を使わずに培養皿から剥離するため、細胞-細胞の結合、細胞-ECMの結合が維持されていることが細胞シートの特徴です。
基板上に吸着したECMの上に細胞が接着しているため、シートの表面は細胞、裏面はECMの構造になっています。
このECMが他の細胞との接着剤の役割を持つため、接着剤を使わずに細胞シート同士を貼り合わせたり、移植した臓器に貼り付けることができるわけですね。
心臓や目などの再生医療で、細胞シート移植の臨床試験などが行われており、とても注目されている培養方法です。
培養例
- 心臓
- 角膜
- 網膜
- 食道 など
あとがき
以上、「細胞の3次元培養の特徴とその培養方法」についてまとめた記事でした。
この記事では3次元培養について、
- 2次元培養の課題について
- 3次元培養とはなにか
- 3次元培養はどんな方法があるか
の項目についておさらいしました。
今回ピックアップしてまとめた培養方法は基本的な概要で、しっかり見ていくともっと細かい分類があったり、応用方法があったりと非常に奥が深いものになっています。
各培養方法の深掘りについては別の記事で随時まとめていくつもりです。
実際に培養するだけでなく、培養したあとの応用(薬効評価、移植など)にどのように役に立つかというところが重要になってくるように思います。
その点についても、気になる報告などがどんどん出てきているのでしっかりと情報を追っていかないといけないですね。
「再生医療のアトリエ」は私が大好きな研究である、再生医療・組織工学という人工的に臓器を作る研究について「とにかく楽しく、わかりやすく」をモットーに叡智を綴る場所です。
よかったところ、わかりにくいところ、もっと知りたいところなどコメントいただけると嬉しいです。
参考文献
スフェロイド、オルガノイド培養
- V Velasco et al. Microtechnology-based methods for organoid models. Microsyst Nanoeng. 2020.(PubMed)
- SM Kang et al. Engineered Microsystems for Spheroid and Organoid Studies. Adv Healthc Mater. 2020.(PubMed)
- ME Sakalem et al. Historical evolution of spheroids and organoids, and possibilities of use in life sciences and medicine. Biotechnol J. 2021.(PubMed)
ゲル培養、ビーズ培養
- LP Ferreira et al. Design of spherically structured 3D in vitro tumor models -Advances and prospects. Acta Biomater. 2018.(PubMed)
スポンジ培養
- A Tripathi et al. Preparation of a sponge-like biocomposite agarose–chitosan scaffold with primary hepatocytes for establishing an in vitro 3D liver tissue model. RSC Adv. 2015.(PubMed)
- F Tortelli et al. Three-dimensional cultures of osteogenic and chondrogenic cells: a tissue engineering approach to mimic bone and cartilage in vitro. Eur Cell Mater. 2009.(PubMed)
脱細胞足場
- P M Crapo et al. An overview of tissue and whole organ decellularization processes, Biomaterials. 2011.(PubMed)
Organ-on-a-chip
- C M Leung et al. A guide to the organ-on-a-chip. Nat Rev Methods Primers. 2022.(PubMed)
3Dプリンター
- M Askari et al. Recent progress in extrusion 3D bioprinting of hydrogel biomaterials for tissue regeneration:a comprehensive review with focus on advanced fabrication techniques. Biomater Sci. 2021.(PubMed)
- Y Ren et al. Developments and Opportunities for 3D Bioprinted Organoids. Int J Bioprint. 2021.(PubMed)
細胞シート






コメント