本記事では、「医薬品開発に貢献する3次元組織培養技術」について、
創薬開発が抱える課題に3次元組織がどのように貢献できるのかをまとめます。
3次元組織と言えば再生医療のイメージですが、実は創薬開発の分野でも活躍が注目されています。
この記事では
- 創薬の背景、課題
- 創薬開発の課題解決に必要なこと
- 3次元組織で貢献できること
の項目についてまとめます。
再生医療発展には3次元組織の構築技術は切っても切り離せないものと言っても過言ではないでしょう。
そんな3次元組織について、これまで当ブログでは種類やメリットについてまとめてきました。
臓器の構造や機能を体の外で再現することができる3次元組織は、再生医療だけでなく創薬開発にも貢献するポテンシャルを秘めています。
今回は、「なぜ創薬開発で3次元組織が注目されているのか?」という入り口の部分について、
創薬開発のプロセスとその課題の整理をしながら、
3次元組織のどんな機能・性質がどのように創薬開発に貢献できるかについての概要をまとめていきます。
再生医療・組織工学という人工的に臓器を作る研究についてまとめた研究まとめ。
創薬開発の背景と課題

まず、本記事の主題でもある3次元組織についておさらいをします。
詳しくはこちらの記事でまとめていますので、本記事ではさらりとまとめます。
3次元組織とは「臓器構造を再現した人工的に構築した生体組織」です。
移植医療の代替となる再生医療を達成するための重要な技術の1つです。
そして、3次元組織は体の外で、臓器の構造や機能を再現することができる特徴を持つことから、創薬開発の分野でもその活用が注目されています。
では、なぜ医薬品の開発に3次元組織の利用が注目されているのでしょうか?
それはどのように活用されようとしているのでしょうか?
これらの疑問について、医薬品開発の流れから順を追ってまとめていきます。
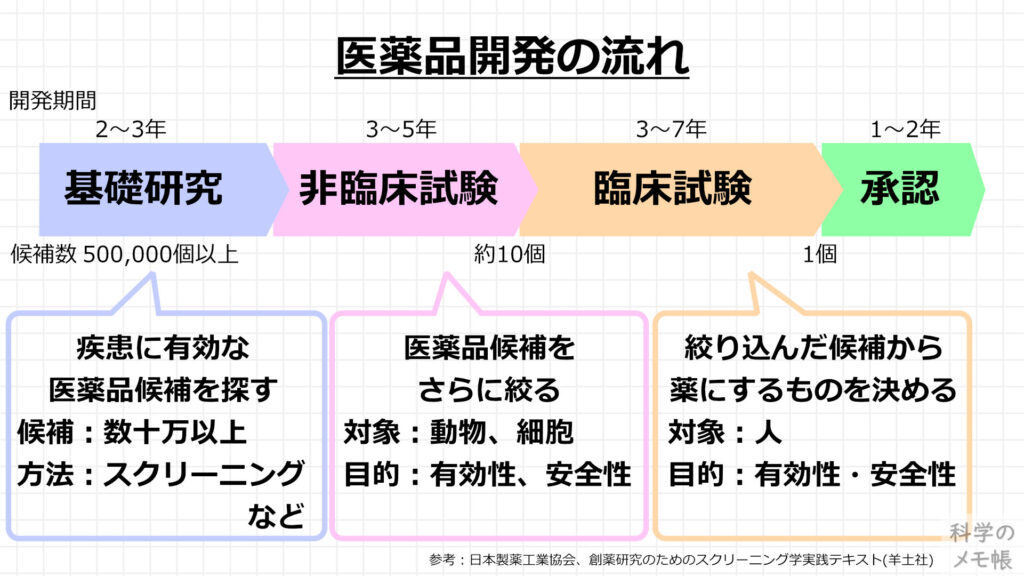
それでは、医薬品開発の流れを確認していきましょう。
今回は本筋ではないのでざっくりと医薬品ができるまでのステップとかかる年数をまとめています。
まず、基礎研究として、疾患に有効な医薬品の候補を数十万以上の物質から、スクリーニングという多量のサンプルを一度に検査する手法を用いて、有効そうな候補を絞ります。(2〜3年)
次に、非臨床試験を行い、基礎研究で目星をつけた候補から、実際にヒトに投与しても有効そうなもの、安全そうなものを絞り込んでいきます。
この時に使う試験方法は動物や培養細胞を用いた方法です。(3〜5年)
最後の試験として、臨床試験を行います。
ここでは、非臨床試験で絞り込んだ医薬品候補を実際にヒトに投与して、有効性・安全性を確認します。(3〜7年)
この試験結果をもとに、販売する医薬品を決め、承認されれば患者に薬を届けることができます。
以上が医薬品の開発の大まかな流れです。
これだけでも開発期間が長いことがわかります。

実際に医薬品開発にかかるコストはどれ程かかっているのかを確認してみると、
- 期間:9〜17年
- 費用:数百億〜数千億円
- 成功確率:0.003%
というのが、1つの薬の開発にかかるコストと言われています。
このコストは製薬企業としても負担が重いもので、日本の大手製薬企業でも開発費の負担に苦しんでいるというニュースも耳にする機会は増えてきたように感じます。
では、この問題の原因は何によるものなのでしょうか?

医薬品開発にかかるコストが膨大になってしまう原因として、
- 医薬品開発でのステップにおける候補の脱落(有効性がない、毒性がある)
- 研究開発費の高騰(低分子→抗体などのバイオ医薬品への複雑化)
- 品質、安全性の向上
など様々な要因があると言われています。
これを解決するためには、会社の開発システムの見直し、AI・ビッグデータなどの活用などの手法による効率化の取り組みが行われています。
この中で今回注目する課題は医薬品開発における失敗、「開発途中での医薬品候補の脱落」についてです。
医薬品の開発における臨床開発のステップだけで、開発費の約50%も占めていると言われています。(参考)
そして、非臨床試験を突破し、臨床試験にまで進んだ医薬品候補のうち、市場に出る確率はたったの8%程度とのこと。
膨大なお金をかけてようやく臨床試験にまで進んでも、その9割は薬になることはないということです。
ということで、「臨床試験での成功率を向上させることができれば、医薬品の開発費を大幅に削減できるのでは」と考えられています。
この問題の解決に当たって大事なのは、
そもそもなぜ臨床試験で失敗するのか?
それまでのステップで有効性や安全性は確認しているのではないか?
という所です。
その要因の一つとして、「基礎研究や非臨床試験で使用する薬の有効性・安全性を確認する評価モデルの予測性が低いこと」が注目されています。
「評価モデルの予測性が低い」というのは、薬の評価をする試験系がヒトの体の応答を正確に再現できておらず、間違えた応答結果を出してしまうということを意味しています。
なぜ評価モデルはヒトの体の応答を正確に再現できないのでしょうか?
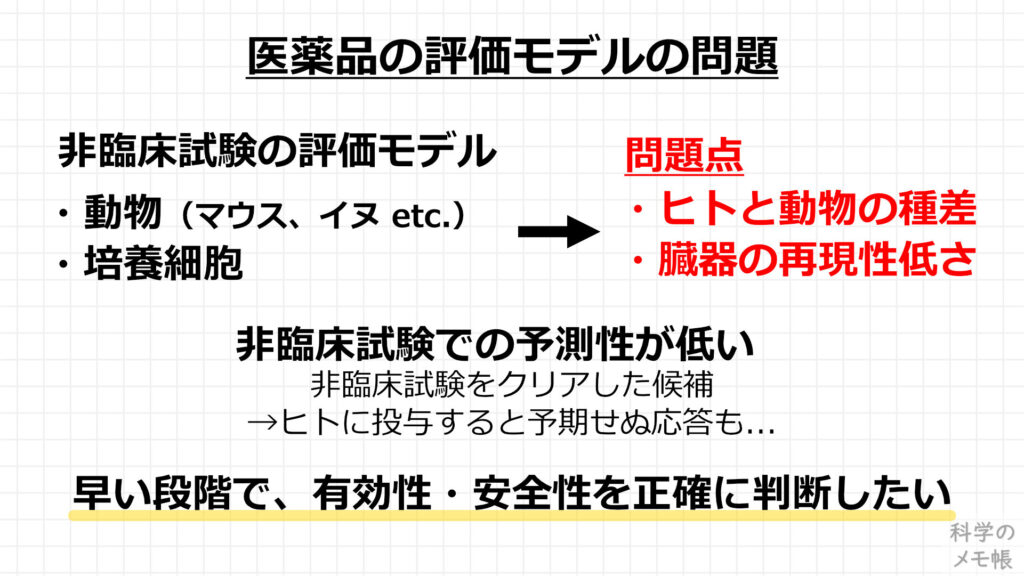
現在、非臨床試験の評価モデルとして、マウスやイヌなどの動物や、培養細胞を用いたin vitroの系が用いられています。
これらが抱える問題として、そもそも動物とヒトとの種差の違い(構成する細胞、臓器の構造・大きさの違いなど)があるため、動物で評価した薬の応答がヒトでも全く同じになることはありません。
また、培養細胞ではプラスチック基板上で培養された細胞を用いており、臓器の構造や機能のほんの一部の機能しか再現することができていません。
これらの理由が、非臨床試験の評価モデルは予測性が低いと言われている原因です。
非臨床試験を突破した医薬品候補でも、ヒトに投与すると治療効果がないだけでなく、予期しない悪影響がでることもあり、
いかに早い段階で有効性、安全性を正確に判断できるかが臨床試験での成功率を向上させるための重要なポイントになります。
創薬開発の問題を解決するためには

それでは、非臨床試験で用いられる評価モデルの予測性が低い問題をどのように解決したら良いでしょうか。
その解決のために求められることが、
「ヒトの体内、臓器を再現したモデルで薬の有効性、安全性を正確に評価できること」
になります。
このようなモデルを実現するためには、
ヒトの細胞で構成された「ヒトの臓器・組織」が必要になります。
そしてこれを達成するための技術が、本ブログで扱っている組織工学をはじめとした人工的に3次元組織(スフェロイド、オルガノイド、臓器チップなど)を構築する技術になります。
次に、なぜ3次元組織であることが正確なモデルを構築するために必要なのか確認していきます。
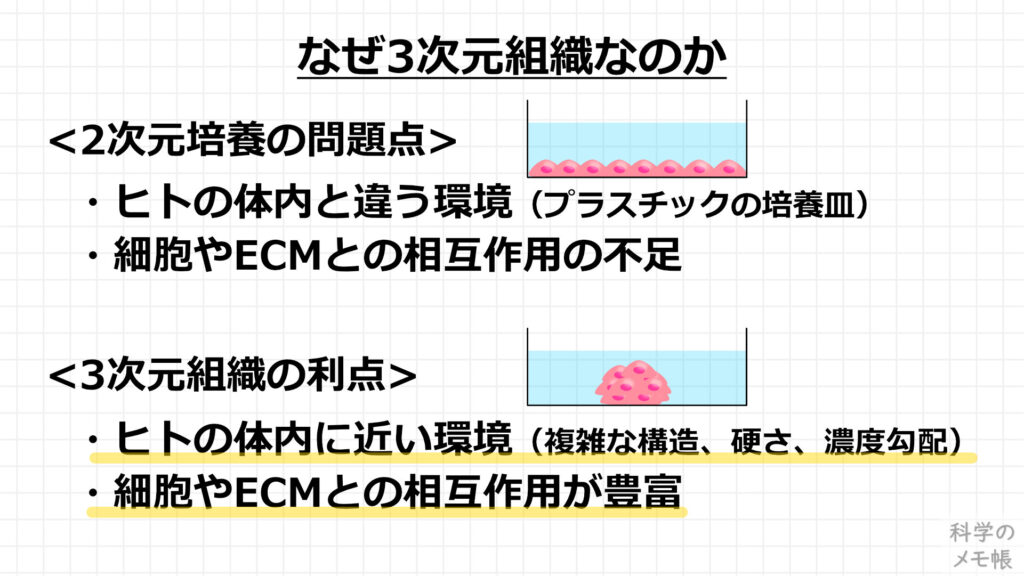
現在でも多く一般的に使われているin vitroの評価系として、プラスチックの培養皿上で単層で培養された細胞(2次元培養)があります。
2次元培養は、これまで多くの実験で用いられてきた実績のあるスタンダードな細胞培養方法であり、細胞の培養方法としても単純で簡便なメリットを持っています。
しかし、プラスチックという硬い材質の上で、細胞にとってはヒトの体内とは全く異なる環境です。
また、本来臓器を構成している細胞は多種類の細胞やECMと相互作用しながら機能を発現していますが、2次元培養ではその相互作用も十分に再現することはできていません。
このことから、2次元培養では本来の体内での細胞の機能を発揮することができていないため、薬の応答が実際のヒトに投与した時とは異なる反応を示します。
一方、3次元組織の場合、細胞が3次元的に積み上がり、細胞は他の細胞やECMを足場とします。
2次元培養の時には不足していた、細胞同士や細胞とECMの相互作用が豊富な状態で培養することができます。
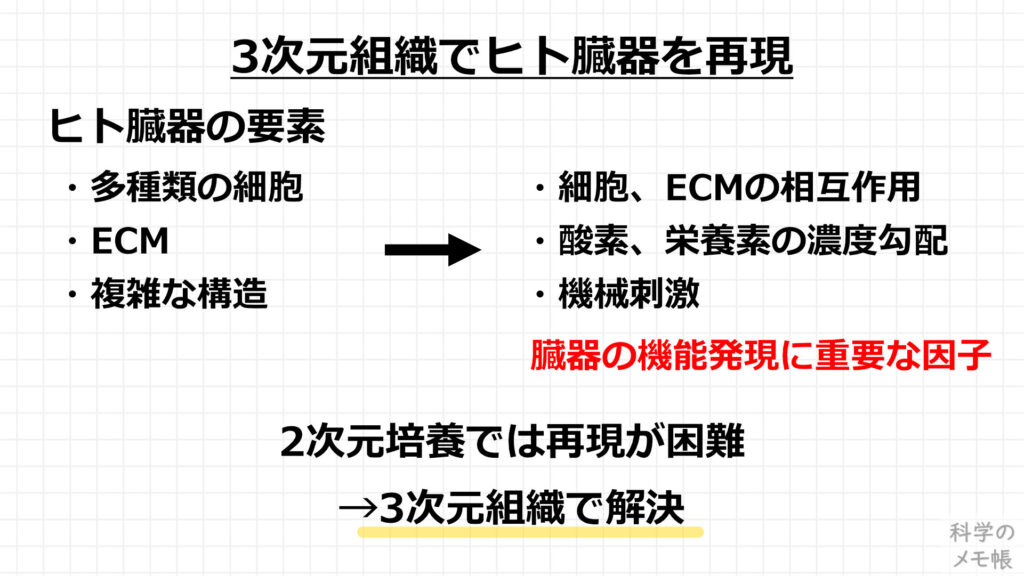
このように、3次元組織を用いることで、ヒト臓器の要素である「多種類の細胞」、「ECM」、「複雑な構造」を人工的に体の外で再現することができます。
これにより、臓器の機能発現に重要な因子である「細胞、ECMの相互作用」、「酸素、栄養素の濃度勾配」、「機械刺激」を、in vitroの培養環境でも制御できるようになります。
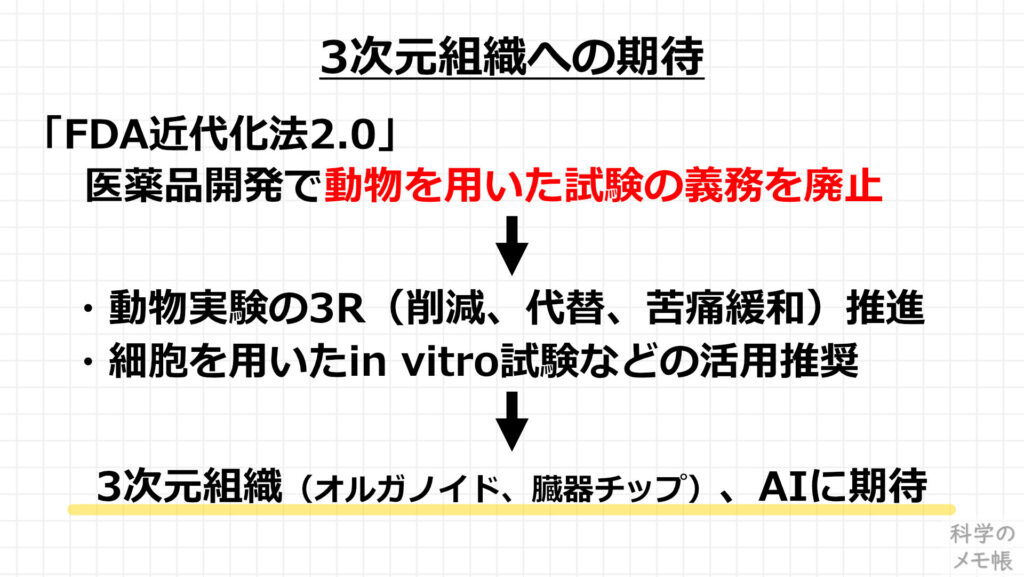
この3次元組織への期待は世界的にも大きいもので、
アメリカ食品医薬品局(FDA:Food and Drug Administration)という、食品や医薬品などを取り締まる政府機関においても、2023年1月に公表した「FDA近代化法2.0」によって、医薬品承認で動物を用いた試験の義務を廃止しました。(参考)
これにより、動物実験の3R(削減、代替、苦痛緩和)を推進するとともに、動物実験の代わりに細胞を用いたin vitro試験などの活用を推奨しています。
このin vitro試験の方法として、オルガノイドや臓器チップといった3次元組織が活躍することが期待されています。
とは言っても、動物実験の”義務の廃止”であるため、動物を絶対に使ってはいけないわけでは無いことや、オルガノイドや臓器チップといった3次元組織の評価方法も発展途上なため、すぐに動物実験が廃止され、in vitro試験に置き換わるということは無いようです。
3次元組織で解決できること
3次元組織を使えばこれまで創薬開発で抱えて来た課題を解決できるかもということで、
次は3次元組織で解決できることについてまとめていきます。
下記の3次元組織の構築方法ごとに確認していきましょう。
- 幹細胞からヒトの細胞、組織を作る
- 組織工学で3次元組織を作る
- 臓器チップで臓器の機能を再現する
幹細胞からヒトの細胞、組織を作る
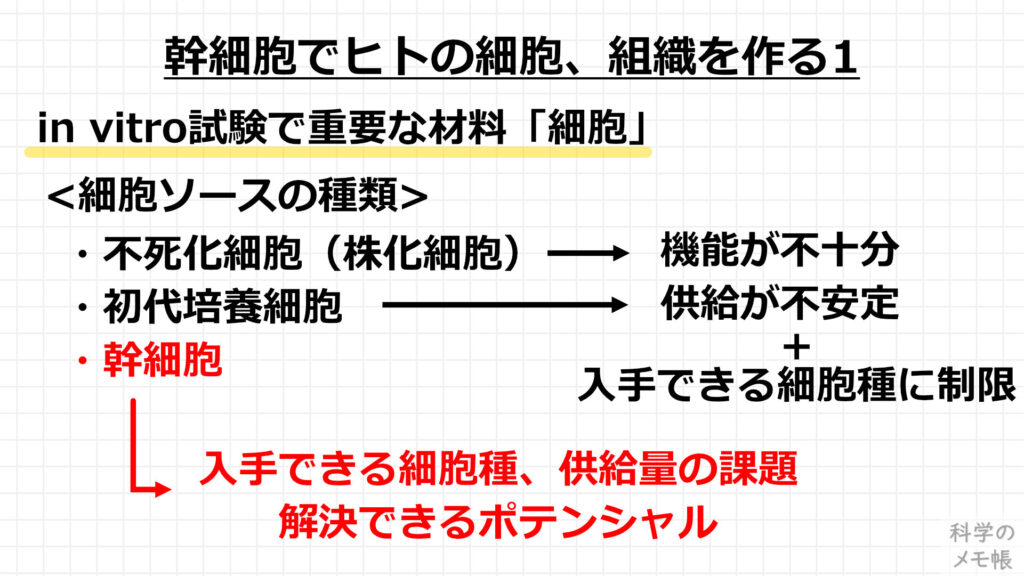
まず「幹細胞でヒトの細胞、組織を作る」についてです。
幹細胞から組織を作るための重要な材料としての細胞から確認していきます。
細胞は他の2つの方法においても欠かすことができない基盤となる材料です。
この細胞ソース(細胞の入手源)は大きく分けて下記の3種類あります。
- 不死化細胞(株化細胞)
- 初代培養細胞
- 幹細胞
不死化細胞(株化細胞)は、特定の種類の細胞を不死化(株化)して、ほぼ無限に増殖できるようになった細胞です。
入手がしやすいため多くの実験でも用いられています。
一方で、株化の際に本来の機能が弱くなってしまい、狙った評価ができない欠点を持ちます。
初代培養細胞は、動物やヒトの臓器から直接採取してきた細胞です。
増殖能力は乏しいものも多いですが、臓器本来の機能を持っていることが大きなメリットです。
一方、心臓や脳といった重要な臓器などの細胞が欲しくても入手が困難なことや、体の外で培養すると機能がすぐに失われることが欠点になります。
幹細胞は、まだ臓器の機能の役割を持つ前の未分化な細胞で、ES細胞やiPS細胞が代表的です。
幹細胞は無限に増殖することができ、分化させることで様々な細胞を得ることができます。
ヒトの様々な臓器の細胞を比較的自由に使うことができる点が、他の細胞ソースよりも優れている所です。
このことから、幹細胞は3次元組織の構築において有望な材料として期待されています。
一方デメリットももちろんあり、幹細胞から分化させた細胞は、本来の臓器の機能が出せない未成熟なものが多いと言われています。
まだ研究の途上であることに注意ですね。
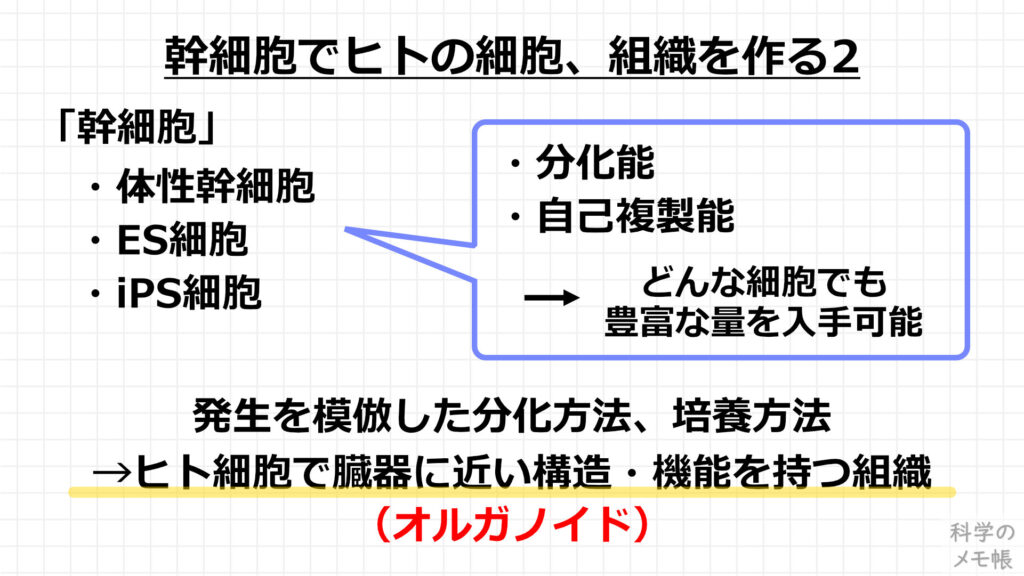
幹細胞でヒトの細胞や臓器を作る事についてより詳細に見ていきましょう。
幹細胞の代表的な種類は3種類あります。
- 体性幹細胞
- ES細胞
- iPS細胞
幹細胞は分化能(色んな種類の細胞になれる事)、自己複製能(増殖能力)に優れており、理論上どんな細胞でも豊富な量を入手できます。
この幹細胞を様々な細胞に変化させる事を分化と言い、これは受精卵から体が形成されるまでの「発生」という過程を人工的に再現する手法が行われています。
具体的には幹細胞に生体の発生で作用している成長因子を適切なタイミングと期間与えてやるというものです。
このような発生過程を真似することで臓器の細胞を作ることができます。
さらにこの方法を発展させて、幹細胞の塊に対して適切な培養環境と成長因子を用いて培養すると、幹細胞の塊が臓器を構成する複数の細胞に分化します。
この時、臓器の特徴的な構造も出来上がることで、まるで臓器のミニチュアのような組織を作ることができます。
これを「臓器のようなもの」という意味でオルガノイド(Organoid)と呼ばれています。
オルガノイドは臓器本来の細胞種と構造を持つため、これまで使われて来た2次元培養や従来の3次元組織よりも、より生体に近い機能をもちます。
これにより、薬の作用がこれまで以上に正確に判定できる事がわかってきています。
組織工学で3次元組織を作る

次は「組織工学で3次元組織を作る方法」を見ていきます。
組織工学はこちらの記事でも解説しているので、さらりと説明すると、「細胞、ECM、成長因子を組み合わせて、臓器に似た構造・機能を持つ組織を人工的に作る技術」です。
例えば
- スポンジ状などの立体的な構造に加工したECMの足場を使って3次元組織をつくる
- 細胞同士を接着させて凝集体をつくる(スフェロイドなど)
- 3Dプリンターを使って細胞を積み上げて立体的な細胞の造形物をつくる
など、様々な技術が開発されています。
この他にも様々な組織構築技術があり、その方法と特性についてはこちらの記事で解説しています。
オルガノイドは作るための培養期間が長く、個体差もあるのに対して、組織工学で作った組織は、人工的に形を作っていくため、培養期間は短く済み、個体差もオルガノイドよりも少ないところがメリットとされています。
オルガノイドとの使い分けとして、培養コストや再現性、薬の応答性のバランスを見て使い分けていくのが良いのではないかとも言われています。(参考)
臓器チップで臓器の機能を再現する

次は「臓器チップで臓器の機能を再現する」事について見ていきます。
臓器チップはμmサイズの流路を持つ基板で細胞を培養します。
電子回路にコンデンサーや抵抗をのせていくイメージに近いです。
この流路に培養液を流す事で、吸収、代謝、排泄、血流の影響など、臓器の中の動的な機能を再現することができる注目の技術です。
小さなチップ上で臓器の機能を再現しているため、Organ-on-a-chipと呼ばれていたり、近年はMicrophysiological system (MPS)と呼ばれたりしています。
ここについての詳細はまた別の記事でまとめます。
この臓器チップは臓器の特徴的な構造と機能をチップの中に作り込み、培養液を流す事で、薬の吸収、代謝、排泄といったこれまでの培養方法では見ることができなかった、体内の薬の動態などを体外で再現できるようになってきました。
例えば、小腸と肝臓の細胞を組み合わせて作られたチップでは、小腸と肝臓の代謝や放出などによる機能がお互いを刺激し合う、臓器間のクロストークという現象を体外で再現可能な培養ができます。(参考)
また、小さなチップ上で臓器の機能を再現できるため、動物を使った試験よりもより効率的に薬の試験ができるようになる事が期待されています。
これまで動物を使って評価して来た、薬の動態についてを、人工的な培養系で評価できるようになるため、世界中で期待が熱い技術です。
臓器チップを先進的に開発している海外のメーカーが検証したところ、現在の動物実験で評価している薬剤誘発性肝毒性試験を肝臓の臓器チップに置き換えると、製薬企業にとって年30億ドルほどの恩恵があるかもとのことです。(参考)
この恩恵は製薬企業だけでなく、薬を必要とする患者にも恩恵があるとのことで、実用化が期待されますね。
まとめ
本記事は、「創薬開発に貢献する3次元組織培養技術」について、
創薬開発が抱える課題に3次元組織がどのように貢献できるのかをまとめました。
薬ができるために多くの時間とコストがかかっており、高度な技術を用いた新しい薬の開発による新薬の開発コストは企業、さらには薬の恩恵を受ける患者を圧迫するものとなってきています。
再生医療や組織工学といった技術によって作られた3次元組織は、上記の問題をすぐに解決できるような夢の技術ではありませんし、まだまだ開発段階であるところです。
しかし、この技術によって貢献できることがあるのも確かなことです。
私もこの分野に携わる者として少しでも貢献していけるよう精進したいと思います。
参考文献
- AS Khalil et al. Engineered tissues and strategies to overcome challenges in drug development. Adv Drug Deliv Rev. 2020.(URL)
- RM Owens. Advanced tissue engineering for in vitro drug safety testing. MRS Communications. 2023.(URL)
- G Jensen et al. 3D tissue engineering, an emerging technique for pharmaceutical research. Acta Pharm Sin B. 2018.(URL)
- P Pound et al. Is it possible to overcome issues of external validity in preclinical animal research? Why most animal models are bound to fail. J Transl Med. 2018.(URL)
- 医薬品産業の現状、厚生労働省(URL)
- 新薬が創る ひろがる未来 てきすとぶっく 製薬産業2022-2023(URL)
- 製薬協:Q33.1つのくすりを開発するのに、どれくらいの年月がかかりますか。(URL)
- 製薬協:医薬品開発協議会 第1回(URL)
- レギュラトリーサイエンスに関する企業の取組み、佐藤弘之(URL)
- in vivoとin vitroによる統合的な医薬品評価と今後の展望、諫田泰成(URL)
- 創薬研究のためのスクリーニング学実践テキスト、羊土社(URL)






コメント