本記事では、「培養肉と再生医療・組織工学」についてまとめていきます。
最近培養肉の話題が注目を集めており、2025年の大阪万博でも培養肉がお披露目されるようです。
そんな培養肉ですが、実はこのブログでも扱っている「再生医療・組織工学」とも非常に関わりが深いものです。
ということで、この記事では培養肉について
- 培養肉とは何か
- なぜ培養肉が必要とされているのか
- 培養肉の歴史
- 培養肉と再生医療・組織工学
- 培養肉の課題
- 培養肉を作る技術
の項目についてまとめます。
本当に人工的に肉を作ることができるのか?
そんな人工的に作った肉は美味しく安全に食べることができるのか?
再生医療・組織工学との関係を確認しながら深堀りしていきます。
再生医療・組織工学という人工的に臓器を作る研究についてまとめた研究まとめ。
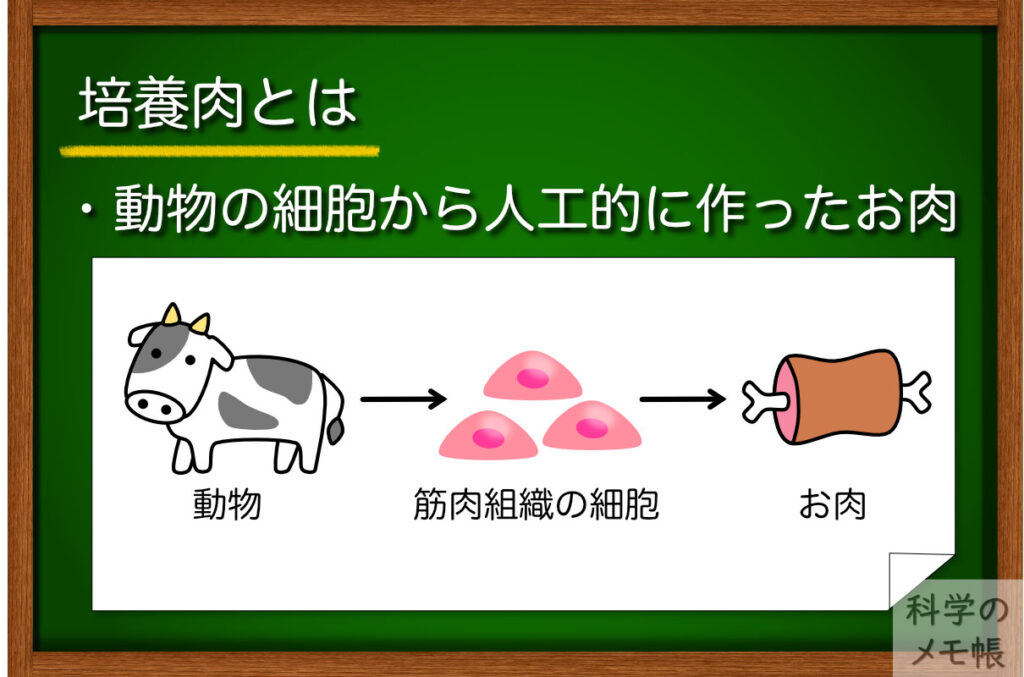
培養肉とは何か
培養肉はバイオテクノロジーを使って、動物の細胞を培養して作る肉や魚介類を指します。(参考)
大豆ミートという大豆などの植物性由来の材料を肉のように加工しているものもありますが、これは「代替肉」と呼ばれていて、培養肉とはまた異なるものです。
日本では培養肉と呼ばれていますが、呼び方は次のように色々あります。
- clean meat
- cultivated meat
- in vitro meat
- cell-based meat
- laboratory grown meat
つまり、培養肉とは動物の細胞を培養して増やし、その細胞を材料にして人工的に肉を再構築するものということです。
なぜ培養肉が必要とされているのか
培養肉の開発が進められている背景は「環境問題」「人口増加」「食糧不足」「安全性」があります。
環境問題については、畜産業は環境への負荷が大きく、気候変動の要因の一つとされています。
お肉や牛乳を供給してくれる牛のゲップは温室効果の高いメタンガスが排出されることは有名ですが、なんとCO2の28倍もの温室効果があるということです。(参考)
動物が温室効果ガスを排出する量は植物の2倍とも言われています。(PubMed)
人口増加に伴う食料不足については、2050年までに人口は97億人になると言われています(2023年では80億人)。
これに伴い、食肉の需要が60〜70%増加すると予想されており、将来的に食料が足りなくなると言われています。
安全性については、インフルエンザや狂牛病(BSE)といった病気などが挙げられます。(PubMed)
鳥や豚のインフルエンザでは毎年何かしらニュースで耳にし、畜産物の供給不足が起きています。
狂牛病では2000年初期に世界中を脅かせ、人の健康にまで影響が出ました。
こういったことから、「おいしい」だけでなくいかに「安全」な食材を供給できるかも畜産業にとっては大きな課題の一つです。
人口増加よって食べ物を沢山作らないといけない。
でもこれ以上畜産業を今のまま拡大することは環境問題や限りある資源(水、土地、エネルギー)といった観点から難しい面もあります。
こういった問題を解決するための方法の一つが培養肉です。
培養肉は既存の畜産業のお肉に対して、
- 水の使用量:89-96% 削減
- 土地の利用料:99% 削減
- 温室効果ガスの排出量:96% 削減
- エネルギー消費量:7-45% 削減
といった効果が見込まれており、非常にクリーンなお肉だと考えられています。(参考1)(参考2)

ちなみに培養肉で注目されているお肉の種類は
- 牛 25%
- 鶏 22%
- 魚 19%
- 豚 19%
という感じで、牛と鶏が人気のようです。(PubMed)
培養肉の歴史
初めて食べることができる培養肉ができたのが、2013年8月5日です。
培養肉で作られたハンバーガーの試食会がロンドンで開催されました。
このときのお値段なんと1個あたり28万ドルとのこと!(参考)
この培養肉が開発された歴史を見てみると、食べることができる細胞を培養するという観点からだと、1995年にin vitroで肉を作る特許が出たこと、2000年のNASAの宇宙食の開発が大きな皮切りとなったのではないかとのことです。(PubMed)
その後、初の培養肉に関するReview論文が出たのが2005年ということで、2000年ぐらいから培養肉の研究が本格的に始まったと言えそうです。(PubMed)
日本で初めての培養肉に関する学会は2018年に「1st Cellular Agriculture Conference in Japan」という題で開催されたそうで、日本ではまだまだ根付いたばかりの分野のようですね。
2018年にアメリカのFDAとFSIS(US Department of agriculture’s food safety and inspection service)が規制を発表し、培養肉の具体的な取り扱いが議論されはじめました。(PubMed)
2020年12月にシンガポールで初めての培養肉の認可が出ました。
2022年11月にはアメリカでも培養肉が承認されました。
現在培養肉の開発に取り組んでいる企業の数は、2020年調べの情報によると、70社以上の企業が培養肉の開発に取り組んでいるようです。(参考)
培養肉と再生医療・組織工学
培養肉のことが少しわかってきた所で、再生医療・組織工学がどのように関わっているのか見ていきます。
実は培養肉の作製には再生医療と特に組織工学の技術が大きく貢献しています。
培養肉を作るためには
- 幹細胞の採取、分離
- 増殖、分化、成熟化のための培地
- 拡大培養技術
- 組織形成
という技術が必要になります。
実はこれは組織工学で移植するための組織を作る技術とほぼ同じです。
移植するためのヒトの組織を作るか、食べるための動物の組織を作るかの違いしかありません。
移植するにしても、食べるにしても、第一に安全であることが必要なため、培養や製造の品質管理のプロセスも似たようなものです。
それでは各技術の詳細の類似点についてまとめていきます。
幹細胞の採取、分離
お肉の組織は、「筋線維 90%」、「脂肪・結合組織 10%」、「血管など 1%以下」といった組成をしています。(PubMed1) (PubMed2)
この組成を構成している細胞は、骨格筋細胞、脂肪細胞、線維芽細胞、軟骨、血管内皮細胞です。
そして、この細胞たちの元になっている幹細胞は、筋衛星細胞、間葉系幹細胞、骨格筋間葉系前駆細胞と呼ばれる細胞で、この3種類の(成体)幹細胞があれば、お肉を構成している細胞をすべて入手することができるようです。(PubMed)
この3種類の幹細胞を動物のお肉の組織から入手するために、細胞の分離技術が必要になります。
その分離技術は、蛍光色素を使った方法(FACS)や磁気ビーズを用いた方法(MACS)などで、細胞を用いたライフサイエンスでとても広く利用されている技術です。
これは、細胞の表面のタンパク質や糖鎖といったマーカーと呼ばれる細胞固有の特徴を頼りに分離する技術になります。
再生医療・組織工学では、ES・iPS細胞から分化した細胞から目的の細胞を分取するときなどに利用しています。
この細胞分離のとき、培養肉の分野ではただ目的のマーカーを持つ幹細胞を見つければ良いだけではなく、増殖能力が高い細胞であることも重要なポイントです。
せっかく幹細胞を分離できても、その細胞が増殖しなくてはお肉は作れませんからね。

培養肉とES・iPS細胞の話
培養肉を作るためには、体から取った成体幹細胞を用いると書きました。
成体幹細胞はES・iPS細胞よりも少し分化が進んでおり、その先に分化することができる種類が限られる幹細胞です。
牛などのiPS細胞は樹立自体はされているそうですが、安定性、スケールアップ、培養コストを下げるための方法が確立しておらず、現時点ではiPS細胞から培養肉を作ることはまだ軌道に乗ることが難しいようです。
成体幹細胞は分化できる先が制限されますが、iPS細胞よりも目的の細胞に分化するのが安定していたり楽だったりと、実は制限があることが良いところだったりします。
できることが限られていることがデメリットのように思いますが、実用化にあたってはメリットになるところが面白いですね。
増殖、分化、成熟化のための培地
材料の大元になる幹細胞を分離したあとは、その細胞をさらに増やして、必要な細胞に分化させて、成熟させる必要があります。
この工程も再生医療と同じですね。
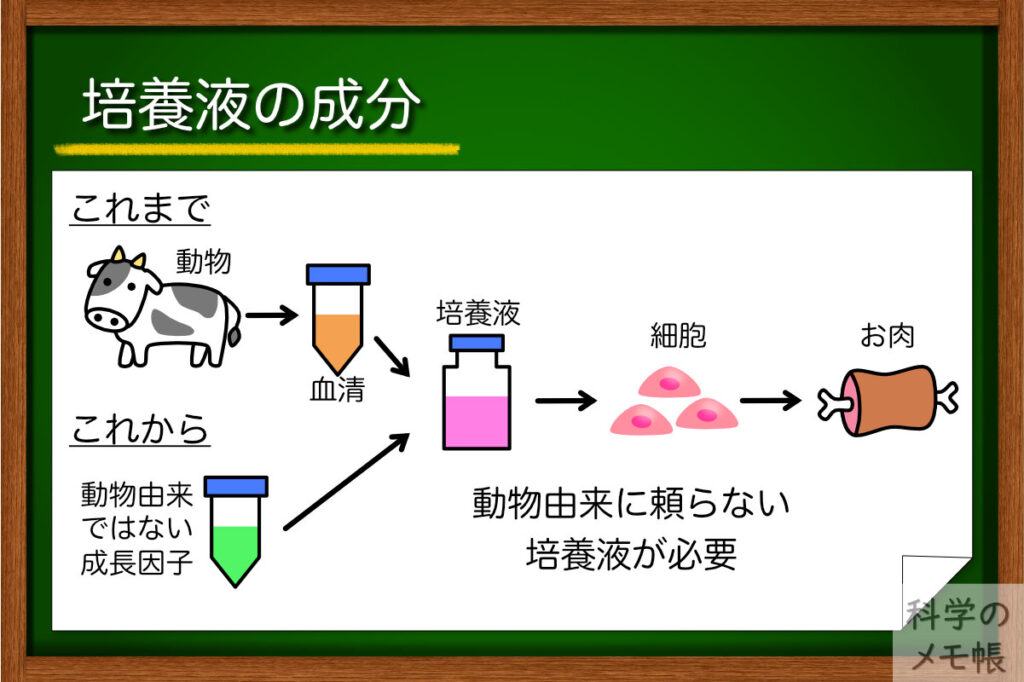
まず必要なものが培地です。
再生医療では人の体に入れるための細胞を作るために、動物由来の成分を使わない培地の開発が進められています。(いわゆるゼノフリー)
この動物由来の成分を使わない培地は培養肉でも注目されています。
通常の細胞培養の培地ではFBS(ウシ胎児血清)といった、成長因子などが豊富に含まれる血清が欠かせません。
ですが、培養肉のコンセプトは「動物に依存しないお肉」です。
FBSのような動物由来の成分を使っていては本末転倒ですね。
コンセプトももちろんですが、FBSはロット間差やブリオン(BSE)といった安定性、安全性の面にも課題があります。(PubMed1) (PubMed2)
再生医療でも無血清培地の開発が進められていますが、この無血清培地はどんな細胞にも使えるものではありません。
通常の血清を用いた培地よりも細胞により最適化させる必要があります。
そのような事情があるため、動物用の無血清培地の開発はまだまだこれからの課題とされています。
また、培地は培養肉のコストにも大きく関わっています。
特に、FBSは培養肉のコストの80%を占めると言われています。(PubMed)
つまり培養液が培養肉のコストの大部分を占めているということです。
このことからFBSの代替となるものを用いなければコストを抑えることはできません。
とは言え、FBSをその他成長因子に置き換えたとしても、培養液のコストのうち成長因子が99%を占めることになると試算されている情報もあります。(参考)
培養肉のコストを下げるためには、ただFBSを代替すればよいだけでなく、成長因子をより安価に生産する技術や仕組みが必要ということです。
拡大培養技術
培地と重なる部分ではありますが、細胞をたくさん効率的に増やすためにはその専用の培養システムが必要です。
再生医療でも臓器の機能を補うほどたくさんの細胞が必要になることから、大量の細胞を培養するためのバイオリアクターという培養技術が使われています。
培養肉でも材料となる細胞を確保するために、このバイオリアクターが用いられています。
バイオリアクターの役目は細胞の増殖と成熟を支える環境を作ることです。
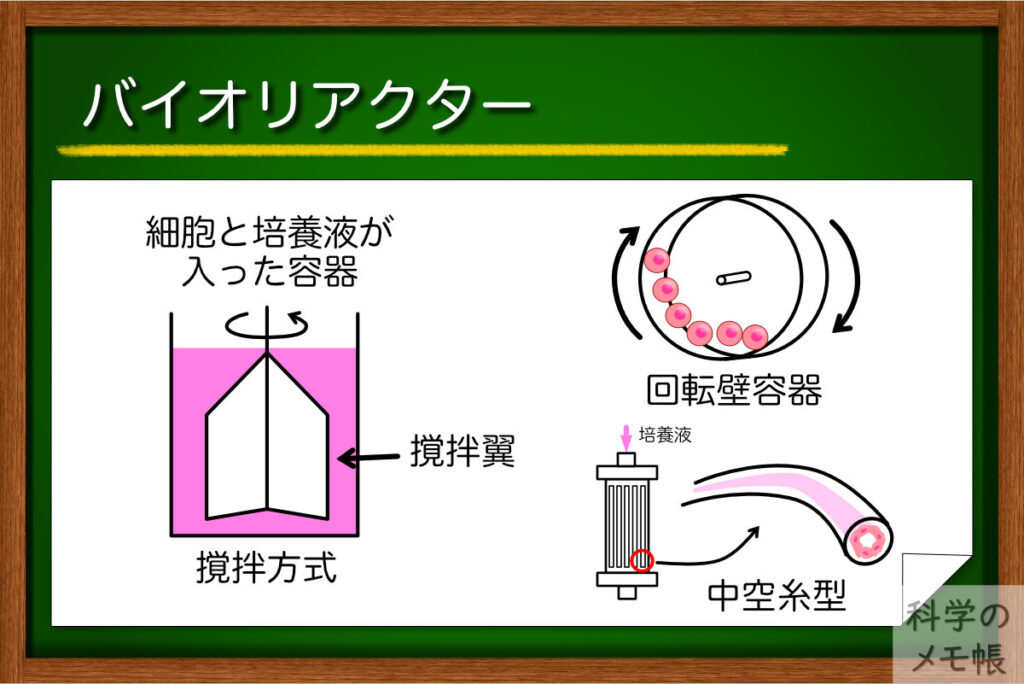
一言にバイオリアクターと言っても、その構造や方式は様々なものがあります。
現在多く使用されている方式は、撹拌タイプのものになります。
その構造は、瓶のようなフラスコの中に回転翼があり、その回転翼によって内部を撹拌しながら細胞を浮遊培養させるというもの。
主に用いられているバイオリアクターは下記のような3種類の培地供給方式があります。
- batch(培地を入れっぱなし)
- fed-batch(細胞の増殖に合わせ、培地を追加していく)
- continuous(培地の追加と細胞・培地の取り出しを行い、連続的に培養する)
この他にも様々な方式のバイオリアクターがあり、
- 回転壁容器
- 中空糸バイオリアクター
このバイオリアクターと合わせて使用する「足場材料」も拡大培養において注目されています。
足場材料といえば組織工学の3要素のうちの1つですね。
拡大培養で用いられる足場材料はマイクロキャリアと呼ばれる直径100〜300 μm程度のビーズです。
これはバイオリアクターという浮遊条件の培養環境に対して、細胞に接着する場所を提供するものです。
細胞をビーズ表面に接着させて培養を行うことで、細胞全体に均一に酸素や栄養を供給することができます。細胞だけで作られた凝集体での培養は、内部まで栄養が届かず、不均一であり内部壊死も起こすことが問題でした。
これにより、細胞の増殖、分化、機能発現をより効率的に行うことができるようになります。(PubMed1) (PubMed2) (PubMed3)
マイクロキャリアの素材としてはデキストラン、ゼラチン、ガラス、キトサン、コラーゲンなどが用いられています。(PubMed1) (PubMed2) (PubMed3)
組織形成
再生医療・組織工学でも最後の決め手と言っても過言ではない(?)組織形成です。
頑張って作った細胞たちをどのように組織にするかによって、機能などに大きく影響します。
再生医療・組織工学では良い細胞をしっかりと臓器のように機能する形で組織を作る必要があると考えられています。
それに対し、培養肉では、主に食感、味に関わる部分であるとされています。
2013年の培養肉の試食会で提供されたものはハンバーガーでした。つまり、ハンバーグを構成するひき肉です。
ひき肉の場合であれば、お肉としての形はそこまで要らないため、もしかしたら今の技術でも良いかもしれません。
しかし、お肉と言えばお肉の部位やステーキといった食べ方など様々な食感も味や食べる楽しみの一つです。
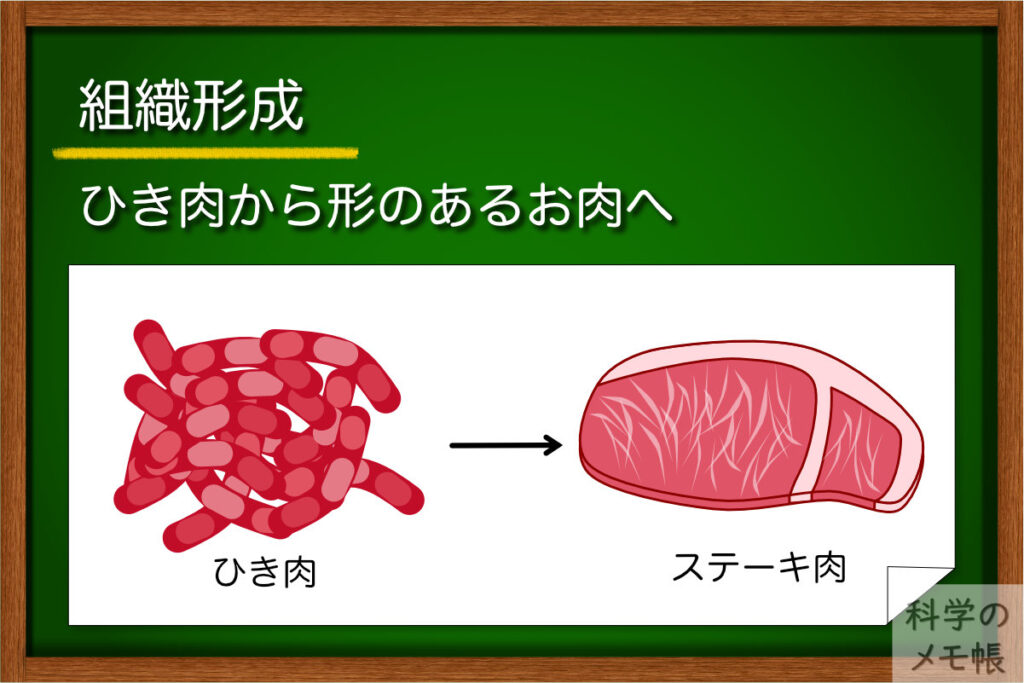
実際のお肉の組織は骨格筋と言われるもので、筋肉の繊維が束になったような構造をしています。
そして、骨格筋の組織の形成は再生医療・組織工学の分野でも注目されており、既に取り組まれています。(PubMed)
このとき重要になるのが前項でもピックアップした足場材料です。
足場は、細胞の分化や組織形成を助ける重要な働きを持っています。(PubMed)
このときに用いる足場材料は、最後にはヒトが食べるものになるので、分解されるか無毒であることが必要です。
組織作製を行うための足場として、3Dプリンターで作製したものを用いることもあります。(PubMed)
このような足場材料はハイドロゲルが使われることが多く、組織工学の知見が大きく期待されています。(PubMed1) (PubMed2)
ハイドロゲル以外にも、エレクトロスピニング法で作製したコラーゲンメッシュ、植物タンパク質が利用されているそうです。(PubMed1) (PubMed2) (PubMed3)

足場材料は必ずしも必要ではない?
組織工学では、組織構築を行うときに細胞・足場材料・成長因子の3要素が鍵とのことでした。
しかし、この中でも足場材料は必要ないケースもあります。
それがScaffold-free(足場なし)の培養方法です。
正確には細胞同士がお互いを足場と見立てて、細胞のみで組織が形成されている状態です。
オルガノイドなど自己組織化するような培養系はこれに近いでしょうか。
再生医療などの分野もScaffold-freeの培養で臓器特異的な構造を再現できてきており、必ずしも足場材料は必要ないのでは…?と思うこともあります。
しかし局所的な構造はできても、大きな筋肉のような全体的に発達したような構造はまだできていないこともあります。
現時点での培養肉では、食感や構造を出してステーキのような肉を作るためには足場材料が必要なのではないかとのことです。(PubMed)
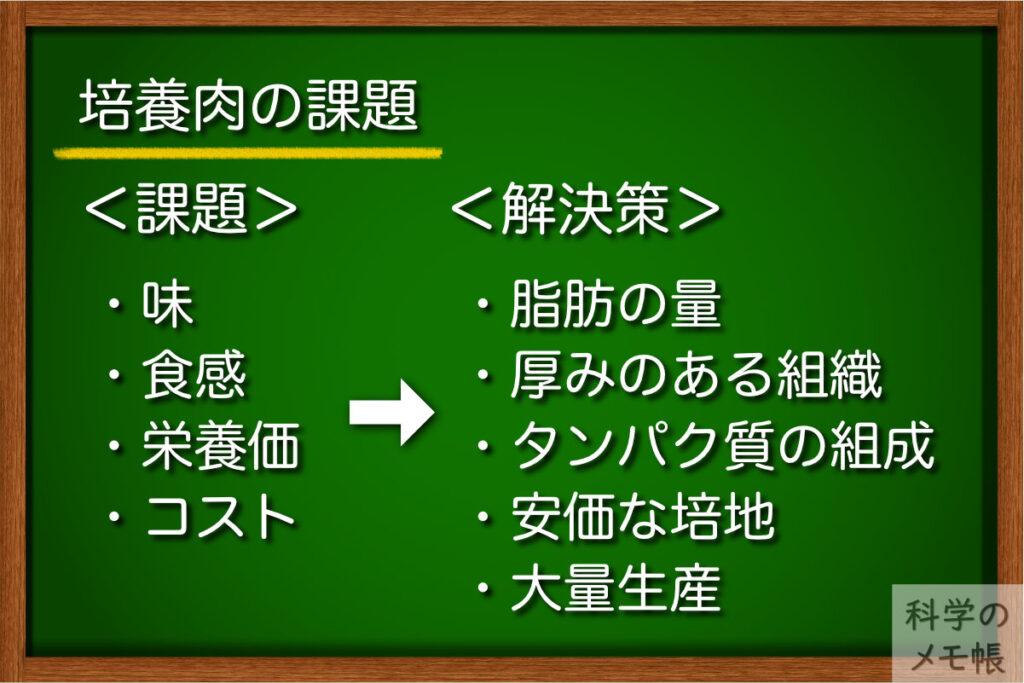
培養肉の課題
環境問題、食糧問題、安全性についての問題を解決してくれそうな夢のような培養肉ですが、もちろんまだ解決しなければいけないことが山積みです。
その一つが味や食感です。
培養肉はまだ一般の人には避けられている傾向が強いそうです。
その理由として、味・食感の不足があるようです。(参考)
(もちろん馴染みのなさ、安全性への不安などもあると思いますが…)
この問題の解決のためには、味・見た目・口当たり・栄養価の点で既存の肉を模倣する必要があると考えられています。(PubMed)
そのために取り組むべき課題は
- 脂肪含有率
- タンパク質組成
- 大きな線維
- 厚みのある構造
とのことで、培養肉を作るときの細胞の比率や組織の成熟化、大きさの追求と再生医療・組織工学の組織作製と重要なポイントが類似しています。
特にステーキのような厚切りのお肉を作ろうとすると、組織内部への栄養・酸素の供給が必要になります。
この栄養・酸素の供給において、3Dプリンティングなどの組織工学も技術が必要になります。
また、コストも大きな問題です。
2013年に試食会があった培養肉のハンバーガーは1個あたり28万ドルでした(2024年2月時点で日本円だと4144万円ぐらい)。
とてもじゃありませんが買えませんね。
この価格は実験室レベルの小規模で作製したことが原因であり、工場規模の大量生産を行うことで既存のお肉と同程度まで安くできるかもと言われているそうです。(参考)
この高いコストの原因は培地が要因として大きく(全体の80%以上を占めている)、動物由来の成分を使用せず、低価格で生産することが必要とのことです。
培養肉を作る技術、作製例
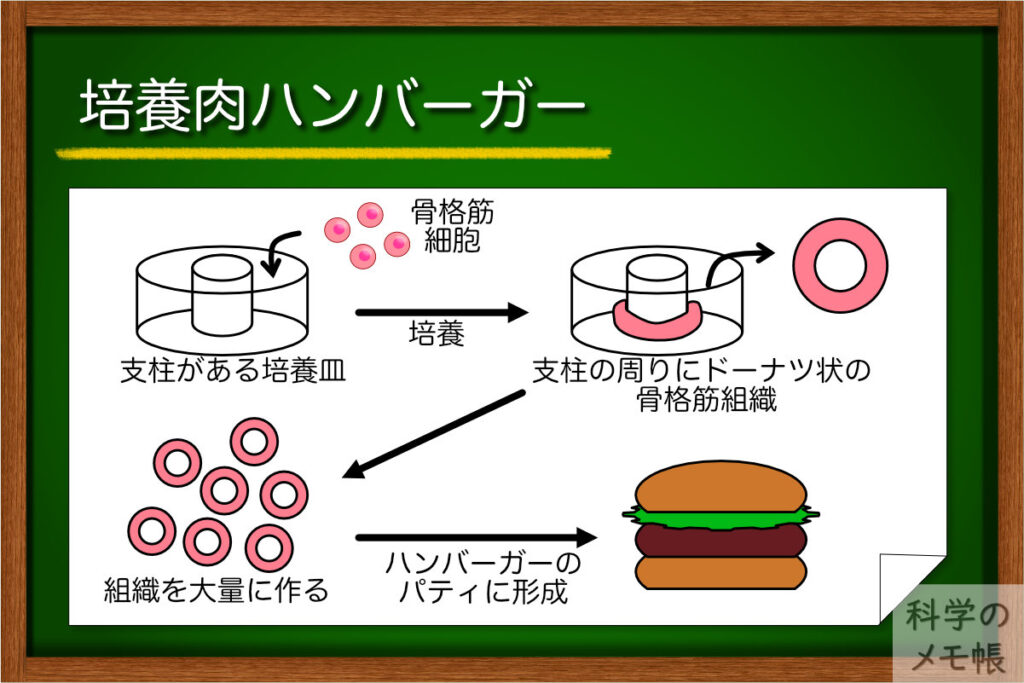
培養肉ハンバーガー
この記事でも何度も登場し、初めて試食が行われたモサ・ミートのハンバーガーで使われた培養肉の作り方を見ていきます。(参考)
筋衛星細胞を培養し増殖させます。
増やした細胞をコラーゲンなどから構成されたゲル前駆体に混ぜ、アガロースゲルの支柱が立っている培養皿に播種します。
数日間培養すると、骨格筋細胞がハイドロゲルを巻き込みながら組織化していき、直径1mm程度のドーナツ状の筋線維組織ができます。
このドーナツ状にすることがこの技術の鍵で、ドーナツ状の筋線維は組織全体に張力がかかり、組織をストレッチさせることで筋肉が発達することで成熟とタンパク質の生成を促進します。(培養肉自身に筋トレさせる感じですね)
3週間培養した組織を回収し、この組織を集めてハンバーグの形にし、焼くことでハンバーガーのパティを作りました。
1つのハンバーガーに使われた培養肉は85 gで、ドーナツ状の組織は焼く1000個ぐらいで構成されているそうです。
3Dプリンターで和牛ステーキ
次は大阪大学、伊藤ハム、島津製作所、TOPPANなどが取り組む培養肉のステーキの作り方です。(PubMed)
骨格筋細胞、脂肪細胞、血管内皮細胞の幹細胞を和牛から採取し、増殖・分化させる。
それぞれの細胞をコラーゲンゲル前駆体に混ぜ、3Dプリンターでファイバーの形状に印刷する。
培養すると、筋線維ファイバー、脂肪・血管ファイバーになる。
このファイバーを束ねて筋肉の組織のように形成し、輪切りにするとステーキのように脂肪のサシが入ったような構造を作ることができる。
ちなみにこの培養肉は、2025年の大阪万博で試食することができるかもしれません。(参考)

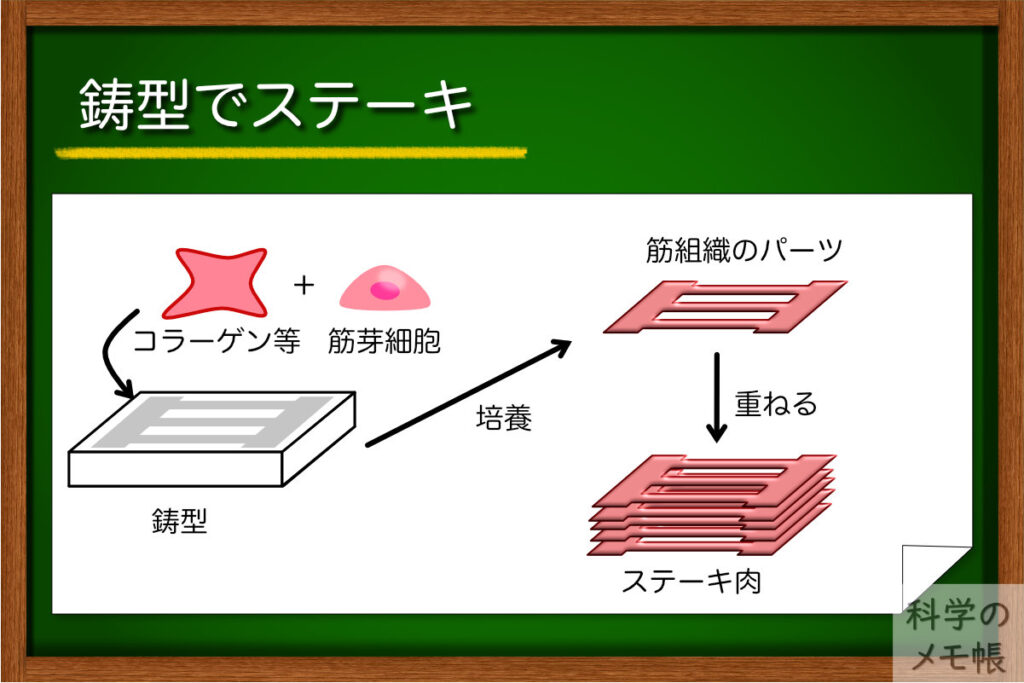
鋳型を使ったステーキ
次は東京大学、日清が手掛ける培養肉のステーキの作り方です。(PubMed)
牛の筋衛星細胞をコラーゲン、フィブリンから構成されるハイドロゲル前駆体に混ぜます。
細長い溝が並んだ構造を持つ鋳型に細胞を混ぜたゲル前駆体を流し込み、培養すると、細胞のファイバーが並んだようなブロックのような板ができます。
このブロックを積み重ねて培養することで、筋肉の線維が並んで束になったような形を作ることができます。
この培養肉はなんと、2022年3月にすでに試食会を行ったとのことです。(参考)
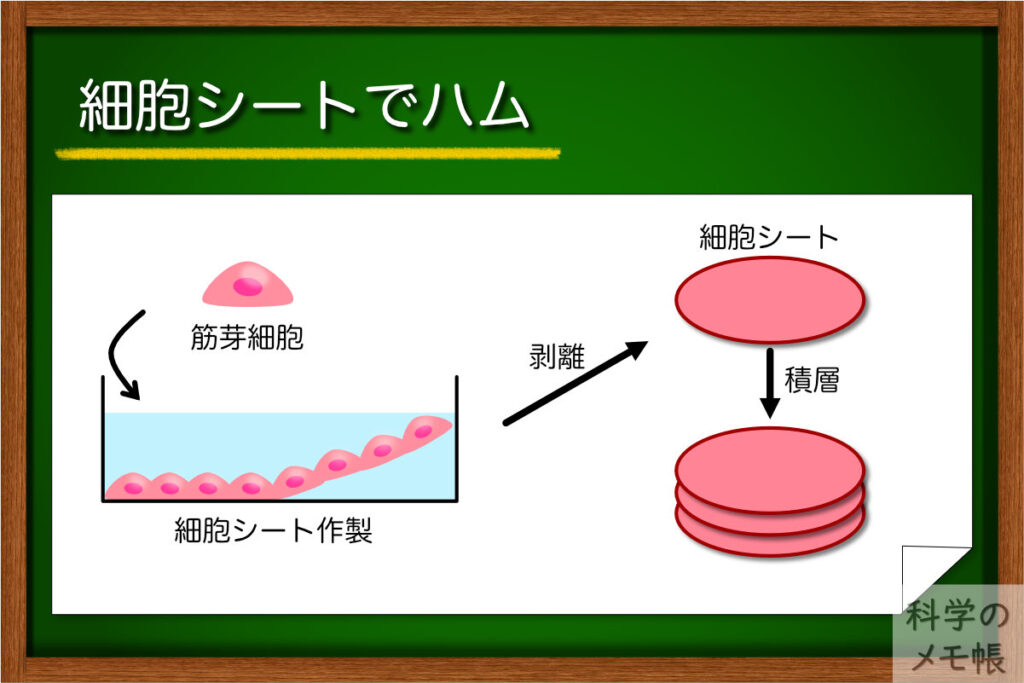
細胞シートでハムを作る
次は東京女子医大学の細胞シートを使ってハムのような培養肉を作る取り組みです。(PubMed)
細胞シートといえば、再生医療でもおなじみの細胞加工技術ですね。
これは使用する細胞を培養肉用にしただけでほぼそのままの技術を培養肉の作製に使用しています。
温度が下がると細胞が剥がれる特殊な培養皿でウシ筋芽細胞を培養します。
数日間培養したあと、細胞を剥がすことでシートを作製、10枚ほど重ねることでハムのような培養肉になります。
こちらのグループは培養肉の作製方法だけでなく、効率の良い培地の開発も行っています。
その方法は、藻類の抽出液を用いることで、グルコース、アミノ酸、ビタミン、その他栄養素を供給するというもの。
高価と言われる培養液を低コスト化できるかもとのことです。
まとめ
以上、「培養肉と再生医療・組織工学」についてのまとめでした。
培養肉について
- 培養肉とは何か
- なぜ培養肉が必要とされているのか
- 培養肉の歴史
- 培養肉と再生医療・組織工学
- 培養肉の課題
- 培養肉を作る技術
の項目について見てみると、「再生医療・組織工学」とも非常に関わりが深いことが良くわかりますね。
再生医療・組織工学で培った技術が培養肉の開発に応用され、培養肉の開発の中で洗練された技術が、また再生医療・組織工学にフィードバックされて両分野で相乗効果的に技術が発展していくと面白いと感じました。
私自身、結構培養肉には興味があるので、もし可能であれば万博での試食に挑戦してみたいところです。
再生医療・組織工学という人工的に臓器を作る研究についてまとめた研究まとめ。
参考文献
- J Reiss et al. Cell Sources for Cultivated Meat: Applications and Considerations throughout the Production Workflow. Int J Mol Sci. 2021.(PubMed)
- CS Mattick et al. Anticipatory Life Cycle Analysis of In Vitro Biomass Cultivation for Cultured Meat Production in the United States. Environ Sci Technol. 2015.(PubMed)
- P Sinke et al. Ex-ante life cycle assessment of commercial-scale cultivated meat production in 2030. The International Journal of Life Cycle Assessment Article. 2023.(PubMed)
- N Stephens et al. Making Sense of Making Meat: Key Moments in the First 20 Years of Tissue Engineering Muscle to Make Food. Front Sustain Food Syst. 2019.(PubMed)
- D Choudhury et al. The Business of Cultured Meat. Trends Biotechnol. 2020 .(PubMed)
- MJ Post. Cultured beef: medical technology to produce food. J Sci Food Agric. 2014. (PubMed)
- A Listrat et al. How Muscle Structure and Composition Influence Meat and Flesh Quality. ScientificWorldJournal. 2016.(PubMed)
- PD Warriss et al. Haemoglobin concentrations in beef. J Sci Food Agric. 1977.(PubMed)
- CF Bentzinger et al. Building muscle: molecular regulation of myogenesis. Cold Spring Harb Perspect Biol. 2012.(PubMed)
- BJ Li er al. Isolation, Culture and Identification of Porcine Skeletal Muscle Satellite Cells. Asian-Australas J Anim Sci. 2015.(PubMed)
- S Ding et al. Maintaining bovine satellite cells stemness through p38 pathway. Sci Rep. 2018.(PubMed)
- PA Redondo et al. Elements of the niche for adult stem cell expansion. J Tissue Eng. 2017.(PubMed)
- A González et al. Corrected: The $280,000 lab-grown burger could be a more palatable $10 in two years.REUTERS. 2019.(参考)





コメント