再生医療で人体の再構築ができるのか?の答えを求めて、生体の組織を人工的に再構築する研究分野である組織工学についての論文を読んで巡った思考を綴ります。
今回ピックアップする論文は「Localization of Multiple Hydrogels with MultiCUBE Platform Spatially Guides 3D Tissue Morphogenesis In Vitro」で2023年にAdvanced Materials Technologiesに掲載された論文です。
オルガノイドやスフェロイドを始め、3次元の培養が盛んになってきています。
細胞の3次元の構造ももちろんであるが、細胞の周りの環境をどのように整えるかというところも注目を浴びています。
その方法として、マイクロ流路や3Dプリンターを使う手段がありますが、今回ピックアップした論文では、ジャングルジムのような立体の格子構造を使って区画ごとにゲルを充填することで細胞周囲の環境を制御するというユニークな研究です。
ゲルという柔らかくて配置制御が難しいものをうまく立体的に配置していて興味深い論文でした。
研究の背景とか課題とか
オルガノイドやスフェロイドを始めとした3次元培養は再生医療、創薬開発の分野で年々注目を増しています。
オルガノイドは生体に近い構造と機能を持つことで期待はされているものの、構造ができる部分はランダムで制御するのが難しいと言われています。
例えば、ゲルの中でオルガノイドを形成したとしても、部分部分を見れば生体にかなり近い構造を有しているものの、同じ作り方をしているのに構造の大きさが違ったり、構成する細胞数が異なっていたりと再現性よく同じ構造を持つオルガノイドを作るのが難しいということ。(参考)
この理由は、体の中と違って、
- 培養条件だと培地の濃度勾配がない
- 周りの環境(ECMの種類など)が均一であり、方向性がない
といった原因があると考えられています。
これを解決するために、マイクロ流路や3Dプリンターを使ってハイドロゲルを配置して周囲の環境を制御する方法などの取り組みがあります。(参考)
しかし、ハイドロゲルというゲル化に時間がかかる、そもそも液体という特性上、そのまま使うだけではうまく制御するのが困難で、ゲル化を早めたりする性質を付与すると、細胞に影響を与えたりするなど、なかなか簡単に解決できるというわけでもありません。
ジャングルジムのような格子状足場を使ってゲルを配置制御する
そんなハイドロゲルの配置制御を行う方法として、ジャングルジムのような立体的な格子構造を持つ足場材料(フレーム)を使って解決を試みた研究が「Localization of Multiple Hydrogels with MultiCUBE Platform Spatially Guides 3D Tissue Morphogenesis In Vitro」で2023年にAdvanced Materials Technologiesに掲載されていました。
この論文では、
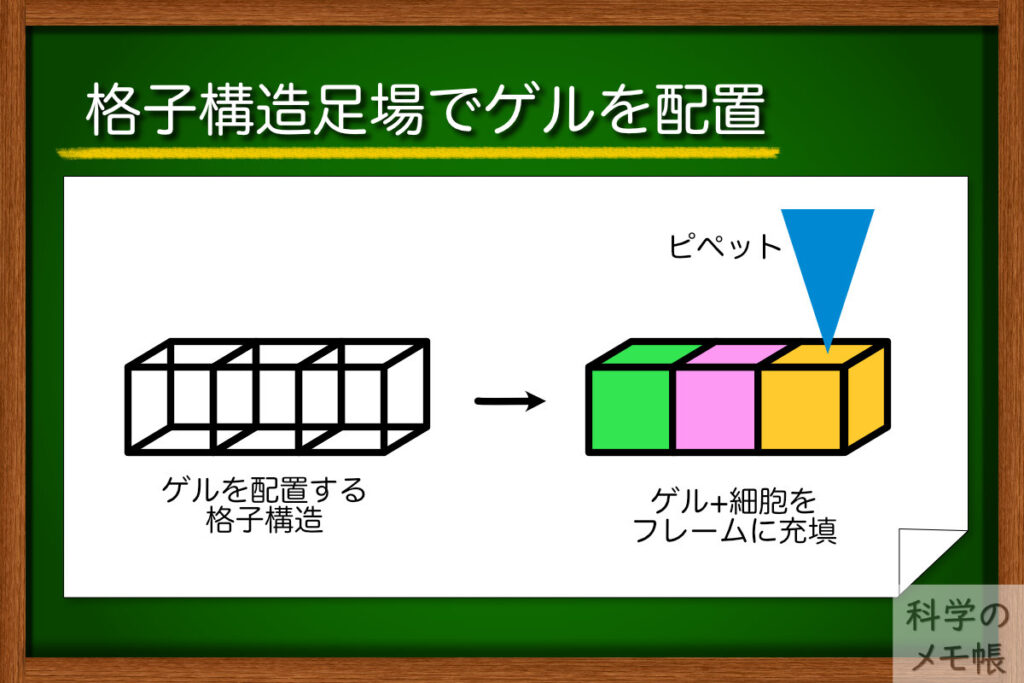
- ハイドロゲルを立体的に配置するために、フレームで構築されたキューブを連結させたような立体的な格子構造を3Dプリンターで作製。
- この格子の各区画にゲル(マトリゲル、フィブリン、コラーゲンなど)をピペットで充填することで、ハイドロゲルを格子構造の中に閉じ込めることで配置制御ができた。
- 3つの区画を用意し、中心部分にがん細胞由来のスフェロイド、その両端に血管内皮細胞を含んだゲルを配置し、培養すると、7日目で両端の血管内皮細胞が、中心部分のがんスフェロイドに向かって血管構造が伸びて浸潤している結果が得られた。
- ゲルに細胞の成長因子を含ませることで、成長因子を含んだ区画と含んでいない区画で上皮細胞の枝分かれ構造の発達の制御ができた。
- ゲルの硬さを区画ごとに調整することでも成長因子の配置制御と同様に細胞の形態形成を部分的に制御できるという結果が出ていた。
といった結果が報告されていました。
ゲルの配置制御の難しさに共感
自分も細胞をゲルで培養する機会がありますが、ゲルが固まるまでに時間がかかる(数分〜数十分)のがとにかく厄介で、この論文の導入で触れられていたゲルは配置制御が難しいというところは本当に共感しました。
もちろんアルギン酸などの早いゲル化をする材料もあり、3Dプリンターではこういった材料を使うことで瞬時にゲル化させ、立体的な構造物を作ることは達成されています。(参考)
ただ、アルギン酸などのゲル化が早い材料は大体細胞の接着能力が低いことが多く、細胞を適切に培養する環境として考えるとそのまま使うことは難しいところです。
そして、細胞にとって良い環境であるECM成分の材料はだいたいゲル化が遅かったり、柔らかすぎて構造を維持することが難しいという、うまいことトレードオフになっています。
こんな課題があり、なんとかオルガノイドやスフェロイド周囲の局所的な部分で制御できないかという観点の論文を見たりするけれど、大体細胞に対して影響がありそうなUV照射、架橋機構を使っているものが多くこれというものがありませんでした。
この論文ではそういったゲルの特性と細胞への影響のトレードオフなところを受け止めた上で両立させているところが非常にアイデアが詰まっていると感じるところです。
論文内では、用意した区画にどうやって安定してゲルを閉じ込めるかについて詳細な検討が行われていました。
一見シンプルそうに見えて、フレームの形や表面の濡れ性など細かく制御された条件の上で成り立っていて繊細な技術だった。
特に表面の濡れ性の条件については、濡れ性のパラメーターである接触角が約70°のときが安定してゲルを保持できるという所で、たまたま偶然なのかはわからないですが、細胞が基板に接着する最適条件である70〜80°付近と一致しているのが興味深いです。
ゲルの溶液がタンパク質であるところと、細胞接着もタンパク質の吸着が重要であるところから、タンパク質と基板の吸着が影響しているのかなと個人的に考察しています。
マトリゲルと結合しやすい成長因子やマトリゲルを架橋させることで硬さを制御するなど、ゲルの応用的な取り扱いがとても勉強になる論文でした。
サイズや観察とか気になる課題について
気になるところとしては、この論文でも課題として取り上げているサイズと観察性についてです。
オルガノイドの部位特異的な細胞周囲環境を制御したい場合、基本的には数百マイクロメートル〜数ミリメートルぐらいのサイズ規模になると思います。
これを制御しようとすると、これぐらいのサイズ間まで下げる必要があるのか、現状の格子のサイズでも工夫次第で解決できてしまうのかどうかが気になりました。
観察についても、透明化技術やライトシート顕微鏡を使った大きな組織の観察も発達してきているので大きさについては許容できるのかなとも思いますが、やはりフレームが光を遮ってしまうことにはどうしようもないのでそこが気になるところです。
他の機構や材料の組み合わせで応用の幅が無限大かもしれない
プリンターなどの特別な装置を使わなくてもデバイスがあればどこでも使うことができるというのは、3次元組織培養ではかなりのアドバンテージだと思います。
フレームの形状と性質的に、今注目を浴びているマイクロ流路デバイス等と組み合わせて培養したりすると面白いことができそうかなと個人的にとても興味があります。
区画に分かれて機能を持ったブロックを作るという発想は電子ブロックに非常に似ていると思うので、それぞれ機能を持ったブロックを作り、ブロックの配置をカスタマイズすることで目的に合わせたMPS(Microphysiological System)を構築できそうでワクワクします




コメント